
【题目】15分)下图所示为一个有机合成反应的流程图:
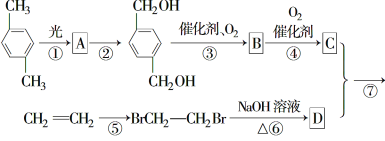

(1)、写出中间产物A、B的结构简式。
A________________, B________________,
(2)、在图中①至⑦的反应中属于取代反应的是________。(填序号)
(3)、写出下列方程式
④ :
⑥:
⑦:
(4)、写出C的同分异构体X,要求符合以下两个条件:
ⅰ.苯环上有两个侧链;
ⅱ.1 mol X与足量NaHCO3溶液反应产生1 mol CO2气体。
写出符合上述两条件的X的所有结构简式____________________________
【答案】(1)  ;(2)①②⑥⑦; (3)
;(2)①②⑥⑦; (3)![]() + O2
+ O2 ![]()
 , CH2BrCH2Br + 2NaOH→CH2OHCH2OH + 2NaBr,2CH2OHCH2OH +
, CH2BrCH2Br + 2NaOH→CH2OHCH2OH + 2NaBr,2CH2OHCH2OH +
![]() 2H2O +
2H2O +  ;(4)
;(4)  。
。
【解析】
试题分析:(1)反应①在光照条件氯气取代两个甲基上的氢原子,则A的结构简式为: ,反应③醇被氧化成醛,其B的结构简式为:
,反应③醇被氧化成醛,其B的结构简式为: ;(2)反应①发生取代反应,反应②是卤代烃的水解,反应③是氧化反应,反应④是氧化反应,反应⑤是加成反应,反应⑥卤代烃的水解,反应⑦是酯化反应,因此属于取代反应的是:①②⑥⑦;(3)反应④是醛基被氧化成羧基,
;(2)反应①发生取代反应,反应②是卤代烃的水解,反应③是氧化反应,反应④是氧化反应,反应⑤是加成反应,反应⑥卤代烃的水解,反应⑦是酯化反应,因此属于取代反应的是:①②⑥⑦;(3)反应④是醛基被氧化成羧基,![]() + O2
+ O2 ![]()
 ,反应⑥是卤代烃的水解,CH2BrCH2Br + 2NaOH→CH2OHCH2OH + 2NaBr,反应⑦发生酯化反应,2CH2OHCH2OH +
,反应⑥是卤代烃的水解,CH2BrCH2Br + 2NaOH→CH2OHCH2OH + 2NaBr,反应⑦发生酯化反应,2CH2OHCH2OH +
![]() 2H2O +
2H2O +  ;(4)X足量的NaHCO3溶液反应生成1molCO2,说明含有羧基,
;(4)X足量的NaHCO3溶液反应生成1molCO2,说明含有羧基, 。
。


 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案科目:高中化学 来源: 题型:
【题目】下列关于化学反应速率的说法中,正确的是( )。
A.化学反应速率是指某一时刻、某种反应物的瞬时反应速率
B.化学反应速率为0.8 mol·L-1·s-1指反应1 s时某物质的浓度为0.8 mol·L-1
C.根据化学反应速率的大小可以推知化学反应的快慢
D.对于一个化学反应来说,其反应速率越大,反应现象就越明显
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)用地壳中某主要元素生产的多种产品在现代高科技中占有重要位置,足见化学对现代物质文明的重要作用。例如:光导纤维的主要成分是 ;目前应用最多的太阳能电池的光电转化材料是 ;
(2)某气态氧化物的化学式为XO2,在标准状况下,1.92 g 该氧化物的体积为672 mL,则该氧化物的摩尔质量为 _____。
(3)某无色溶液X,由K+、NH4+、Ba2+、Al3+、Fe3+、CO32-、SO42-中的若干种离子组成,取该溶液进行如下实验:
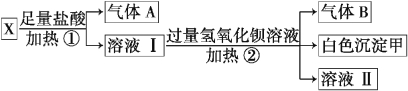
(1)白色沉淀甲是________。
(2)试写出实验过程中生成气体B的离子方程式 _________________________。
(3)通过上述实验,可确定X溶液中一定存在的离子是_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某天然有机化合物A仅含C、H、O元素,与A相关的反应框图如下:
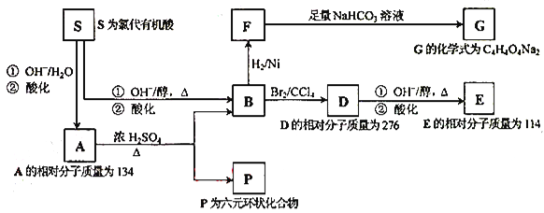
(1)写出A、P、E、S的结构简式
A: 、P: 、E: 、S: 。
(2)写出在浓H2SO4存在并加热的条件下,F与足量乙醇反应的化学方程式:
。
(3)写出与D具有相同官能团的D的所有同分异构体的结构简式:
①
②
③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化氯(ClO2)是一种黄绿色易溶于水的气体,常用作饮用水消毒。实验室通过如下过程制备二氧化氯。
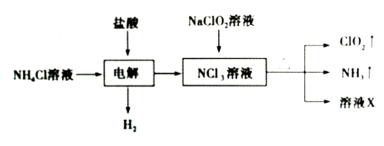
下列说法正确的是
A.电解时发生反应的离子方程式为:NH4++3Cl-![]() 2H2↑+NCl3
2H2↑+NCl3
B.溶液X中大量存在的阴离子有Cl-、OH-
C.可用饱和食盐水除去ClO2中的NH3
D.可用明矾除去饮用水中残留的NaClO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某地区的自来水是采用氯气消毒的,为了检验Cl-的存在,最好选用下列物质中的 ( )
A.石蕊溶液 B.四氯化碳 C.氢氧化钠溶液 D.硝酸银溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上采用氨的催化氧化制备硝酸,起反应如下:
![]()
![]()
设空气中氧气的体积分数为0.20,氮气的体积分数为0.80
(1)为使NH3恰好完全氧化为NO,氨-空气混合物中氨的体积分数为 (用小数表示,保留2位小数)
(2)1mol NH3完全转化HNO3,若在此过程中不补充水,则所得HNO3溶液的质量分数为 (用小数表示,保留2位小数)
(3)已知NH3完全转化NO的转化率为95%,由NO转化HNO3的转化率为92%.请计算用17吨NH3可制取质量分数为0.63的硝酸溶液为 吨
(4)硝酸工业生产中的尾气可用纯碱溶液吸收,有关的化学反应为:
![]() ①
①
![]() ②
②
若每生产1mol CO2,吸收溶液质量就增加40g。计算吸收液中NaNO2和NaNO3物质的量之比为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】煤燃烧排放的烟气含有SO2和NOx,形成酸雨、污染大气,采用NaClO2溶液作为吸收剂可同时对烟气进行脱硫、脱硝。回答下列问题:
(1) NaClO2的化学名称为____________。
(2)在鼓泡反应器中通入含有SO2和NO的烟气,反应温度为323 K,NaClO2溶液浓度为5×103mol·L1。反应一段时间后溶液中离子浓度的分析结果如下表。
离子 | SO42 | SO32 | NO3 | NO2 | Cl |
c/(mol·L1) | 8.35×104 | 6.87×106 | 1.5×104 | 1.2×105 | 3.4×103 |
①写出NaClO2溶液脱硝过程中主要反应的离子方程式 。增加压强,NO的转化率________________(填“提高”、“不变”或“降低”)。
②随着吸收反应的进行,吸收剂溶液的pH逐渐___________(填“增大”“不变”或“减小”)。
③由实验结果可知,脱硫反应速率___________脱硝反应速率(填“大于”或“小于”)。原因是除了SO2和NO在烟气中的初始浓度不同,还可能是___________。
(3)不同温度下,NaClO2溶液脱硫、脱硝反应中,SO2和NO的平衡分压Pe如图所示。
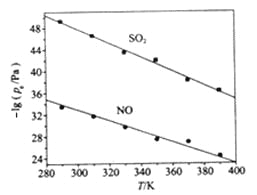
①由图分析可知,反应温度升高,脱硫、脱硝反应的平衡常数均____________(填“增大”、“不变”或“减小”)。
②反应ClO2+2SO32===2SO42+Cl的平衡常数K表达式为___________。
(4)如果采用NaClO、Ca(ClO)2替代NaClO2,也能得到较好的烟气脱硫效果。
①从化学平衡原理分析,Ca(ClO)2相比NaClO具有的优点是_______。
②已知下列反应:
SO2(g)+2OH(aq)===SO32(aq)+H2O(l) ΔH1
ClO(aq)+SO32(aq)===SO42(aq)+Cl(aq) ΔH2
CaSO4(s)===Ca2+(aq)+SO42(aq) ΔH3
则反应SO2(g)+ Ca2+(aq)+ ClO(aq) +2OH(aq) ="==" CaSO4(s) +H2O(l) +Cl(aq)的ΔH= _。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢化亚铜(CuH)是一种不稳定的物质,能在氯气中燃烧,也能与酸反应。用CuSO4溶液和“某物质”在40~50℃时反应可生成CuH。下列叙述中错误的是( )
A.“某物质”具有还原性
B.CuH与盐酸反应可能产生H2
C.CuH与足量稀硝酸反应:CuH+3H++NO3-=Cu2++NO↑+2H2O
D.CuH在氯气中燃烧:CuH+Cl2=CuCl+HCl
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com