
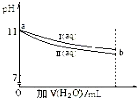
| A. | I 和 II 溶液中,离子种类数相同 | |
| B. | a 点处,I 溶液的浓度为 10-3mol?L-1 | |
| C. | a 点处,I、II 对水的电离平衡影响相同 | |
| D. | b 处的 I、II 溶液分别与盐酸反应,I 消耗 HCl 物质的量比 II 多 |
分析 A.氢氧化钠溶液中存在钠离子、氢离子和氢氧根离子,醋酸钠溶液中醋酸根离子水解,溶液中存在离子为醋酸根离子、钠离子、氢离子、氢氧根离子;
B.图象分析可知,加水稀释氢氧化钠溶液PH变化大,醋酸钠溶液PH变化小,I为醋酸钠溶液;
C.醋酸钠溶液中醋酸根离子水解促进水的电离,氢氧化钠溶液是碱溶液抑制水的电离;
D.b处醋酸钠溶液中醋酸水解平衡,平衡状态下氢氧根离子浓度和氢氧化钠溶液中氢氧根离子浓度相同,醋酸钠溶液中消耗盐酸多.
解答 解:A.氢氧化钠溶液中存在钠离子、氢离子和氢氧根离子,醋酸钠溶液中醋酸根离子水解,溶液中存在离子为醋酸根离子、钠离子、氢离子、氢氧根离子,I 和 II 溶液中,离子种类数不相同,故A错误;
B.图象分析可知,加水稀释氢氧化钠溶液PH变化大,醋酸钠溶液PH变化小,I为醋酸钠溶液,溶液中氢氧根离子浓度为10-3mol/L,醋酸钠溶液浓度大于10-3mol/L,故B错误;
C.醋酸钠溶液中醋酸根离子水解促进水的电离,氢氧化钠溶液是碱溶液抑制水的电离,对水的电离程度不同,故C错误;
D.b处醋酸钠溶液中醋酸水解平衡,平衡状态下氢氧根离子浓度和氢氧化钠溶液中氢氧根离子浓度相同,醋酸钠溶液中消耗盐酸多,b 处的 I、II 溶液分别与盐酸反应,I 消耗 HCl 物质的量比 II 多,故D正确;
故选D.
点评 本题考查了弱电解质电离平衡、盐类水解的影响因素分析,图象变化特征是解题关键,题目难度中等.


 海淀黄冈名师导航系列答案
海淀黄冈名师导航系列答案科目:高中化学 来源: 题型:解答题
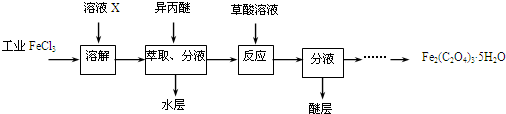
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
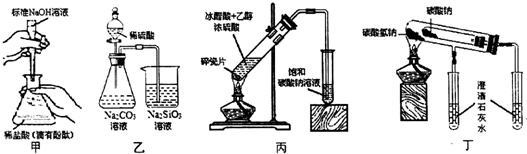
| A. | 甲装置:测定盐酸的物质的量浓度 | |
| B. | 乙装置:验证H2SO4、H2CO3、H2SiO3酸性的强弱 | |
| C. | 丙装置:实验室制备乙酸乙酯 | |
| D. | 丁装置:比较碳酸钠和碳酸氢钠的热稳定性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 对实验Ⅰ~Ⅳ的实验操作现象判断正确的是( )
对实验Ⅰ~Ⅳ的实验操作现象判断正确的是( )| A. | 实验Ⅰ:产生红褐色沉淀 | B. | 实验Ⅱ:溶液颜色变红 | ||
| C. | 实验Ⅲ:放出大量气体 | D. | 实验Ⅳ:先出现白色沉淀,后溶解 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | BaSO4(s)?Ba2+(aq)+SO42-(aq) | B. | HClO=H++ClO- | ||
| C. | NaHSO3=Na++H++SO32- | D. | H2S+H2O?H3O++HS- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 均存在电离平衡 | B. | 阴离子数目前者大于后者 | ||
| C. | c(OH-)前者小于后者 | D. | 存在的粒子种类相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用pH试纸测双氧水的pH | |
| B. | 用酸式滴定管量取20.00 mL酸性K2Cr2O7溶液 | |
| C. | 用托盘天平称取 5.85 g NaCl晶体 | |
| D. | 用带磨口玻璃塞的试剂瓶保存Na2CO3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②⑤ | B. | ②④⑥ | C. | ②④ | D. | ③⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
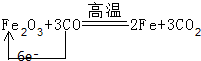 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com