
һ������������(����������������)������������Ʒ�Ĺ�ҵ�������£�
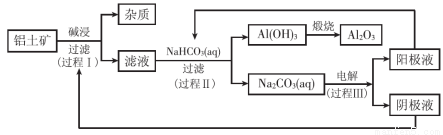
��1������I��������Ӧ�����ӷ���ʽ�� ��
��2������II����һ��Ũ�ȵ�NaHCO3��Һ�����������Һ��������ҺpH��Al(OH)3���ɵ��������NaHCO3��Һ����仯���������£�

�� ����NaHCO3��Һ���С��8 mLʱ��������Ҫ��Ӧ�����ӷ���ʽ�� ��
�� ����II����Al(OH)3�����ӷ���ʽ�� ��
��3������III�����Na2CO3��Һ��װ������ͼ��ʾ��
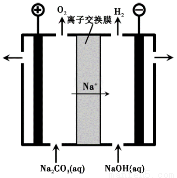
�� �����ĵ缫��Ӧʽ�� ��
�� ��������Һ���ɵ�ԭ���� ��
 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ��2016-2017ѧ�������������ʡ��ʡ��У�߶������л�ѧ�Ծ��������棩 ���ͣ�ѡ����
��֪
��H2(g)+1/2O2(g)=H2O(l) ��H =-284.2kJ /mo1
��2NH3(g)+3/2O2(g)=N2(g)+3 H2O(l) ��H =-760.2 kJ /mo1
�����֪1/2 N2(g)+ 3/2H2(g)= NH3(g) �ġ�H�ǣ� ��
A��-91.96 kJ/mol B��-104.5 kJ/mol
C��+476.52 kJ/mol D��-46.2 kJ/mol
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2017�����ʡ������ͨμ�ظ�����ѧ����ĩ��ѧ�Ծ��������棩 ���ͣ�ʵ����
ijУ��ѧ��ȤС��Ϊ�о�Cl2���ʵ����ʣ������ͼ��ʾװ�ý���ʵ�飮װ��III�мг�װ������ȥ������aΪ�����Ʒ����ֽ��bΪʪ���Ʒ����ֽ��

��1��ʵ�����Զ������̺�Ũ�����Ʊ������Ļ�ѧ����ʽ�ǣ� ��
��2������ҩƷǰ�����������巢�� װ�������ԵIJ����ǣ� ��
װ�������ԵIJ����ǣ� ��
��3��װ�â�������� ��
��4��ʵ������У�װ�â��е�ʵ������Ϊ ��������Ӧ�Ļ�ѧ����ʽΪ ��
��5��ʵ���������ͬѧ��װ�â��й۲�b�ĺ�ɫ��ȥ�����Dz�δ�۲쵽��a�����Ա仯����һԤ������Ϊ�˴ﵽ��һĿ�ģ�����ΪӦ�� ֮�仹������ϴ��ƿ��ѡ��װ����ţ�����װ�õ�������  ��
��
��6��װ�â���Ŀ���Ƿ�ֹβ����Ⱦ������д��װ�â��з�����Ӧ�����ӷ���ʽ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2017�츣��ʡ��������������ѧ���������棩 ���ͣ�ѡ����
��һ���¶��£�������X������Y��0.16mol����10L�����ܱ������У�������ӦX(g) + Y(g)  2Z(g) ��H��0��һ��ʱ���ﵽƽ�⣬��Ӧ�����вⶨ���������±���
2Z(g) ��H��0��һ��ʱ���ﵽƽ�⣬��Ӧ�����вⶨ���������±���
t/min | 2 | 4 | 7 | 9 |
n(Y)/mol | 0.12 | 0.11 | 0.10 | 0.10 |
����˵����ȷ����
A��0��2min��ƽ�����ʦ�(Z) = 2.0��10��3mol��L��1��min-1
B�������������䣬�����¶ȣ���Ӧ�ﵽ��ƽ��ǰ��(��)����(��)
C�����¶��´˷�Ӧ��ƽ�ⳣ��K =1.44
D�������������䣬�ٳ���0.2molZ��ƽ��ʱX�������������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2017�츣��ʡ��������������ѧ���������棩 ���ͣ�ѡ����
��ǿ������ɫ��Һ�У������������ܴ����������
A��Na+��K+ ��OH-��Cl- B��Na+��Cu2+��SO42-��NO3-
C��K+��Mg2+��SO42-��Cl- D��Ba2+��HCO32-��NO3-��K+
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2017�챱���к�����������ѧ����ĩ��ѧ�Ծ��������棩 ���ͣ�ѡ����
����������ͭ����ƽ�⣺Cu(OH)2 + 2OH�� Cu(OH)42��������ɫ����ijͬѧ��������ʵ�飺
Cu(OH)42��������ɫ����ijͬѧ��������ʵ�飺

����˵������ȷ����
A. ���г�����ɫ����
B. ����������Cu(OH)2 + 2OH�� Cu(OH)42�������ƶ��Ľ��
Cu(OH)42�������ƶ��Ľ��
C. ��������֤�������Ǿ��л�ԭ��
D. �ԱȢںܿ͢�֪Cu(OH)2������ǿ��Cu(OH)42��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2017�챱���к�����������ѧ����ĩ��ѧ�Ծ��������棩 ���ͣ�ѡ����
������ˮ�����ķ����У���ʾ��ԭ�������ӷ���ʽ����ȷ����
A��������������������������Al3++3H2O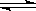 Al(OH)3+3H+
Al(OH)3+3H+
B���кͷ����ù���CO2�кͼ��Է�ˮ��CO2+2OH��=CO32��
C������������Na2S������Hg2+��ˮ��Hg2++S2��=HgS��
D��������ԭ������FeSO4�����Է�ˮ��Cr2O72����ԭΪCr3+��Cr2O72��+6Fe2++14H+=2Cr3++6Fe3++7H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2017��㶫ʡ��������У������ѧ�ڵ�һ��������ѧ���������棩 ���ͣ�ʵ����
�ȱ���( )���ٴ���һ�ֽ�֬��Ѫ˨ҩ�����һ���ϳ�·�����£�
)���ٴ���һ�ֽ�֬��Ѫ˨ҩ�����һ���ϳ�·�����£�
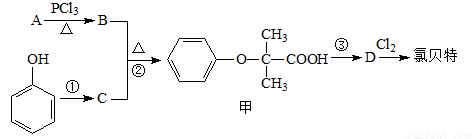
��ʾ����ͼ�в��ַ�Ӧ���������ַ�Ӧ�����������ȥ��
��
��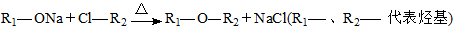
���ȱ��صķ���ʽΪ ��
����8.8 g A������NaHCO3��Һ��Ӧ����2.24 L CO2(��״��)����B�ĺ˴Ź��������������壬��A�Ľṹ��ʽΪ ��(���ԭ��������H-1��C-12��O-16)
��Ҫʵ�ַ�Ӧ����ʾ��ת���������������ʲ��ܴﵽĿ�ĵ��� (��ѡ����ĸ)��
a��Na b��NaOH c��NaHCO3 d��CH3COONa
�ȷ�Ӧ�ڵķ�Ӧ����Ϊ ���������ж���ͬ���칹�壬ͬʱ �����������������м�ͬ���칹���� ��(�����������칹)��
�����������������м�ͬ���칹���� ��(�����������칹)��
�� 1��3��5-��ȡ������
�� �������� �Ҽ�����FeCl3��Һ����ɫ�����ܷ���������Ӧ��
�Ҽ�����FeCl3��Һ����ɫ�����ܷ���������Ӧ��
�� 1 mol��ͬ���칹���������3 mol NaOH��Ӧ��
��д��B������NaO H��Һ��Ӧ�Ļ�ѧ����ʽ ��
H��Һ��Ӧ�Ļ�ѧ����ʽ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2017��㶫ʡ��ͷ�и�����ѧ����ĩ��ѧ�Ծ��������棩 ���ͣ�ѡ����
X��Y��Z���ֶ�����Ԫ�أ�ԭ�Ӱ뾶�Ĵ�СΪ��r(Y)> r(X)> r(Z),����Ԫ�ص�ԭ������֮��Ϊ16��X��Y��Z����Ԫ�صij������������ʵ������¿ɷ�����ͼ�仯������B��C��Ϊ10���ӷ��ӡ�����˵������ȷ����
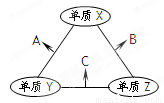
A. XԪ��λ�ڢ�A �� B. A���ܽ���B��
C. A��C�����ܷ���������ԭ��Ӧ D. B�ķе����C�ķе�
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com