
| A. | O、S、Na的原子半径依次增大 | B. | LiOH、KOH、CsOH的碱性依次减弱 | ||
| C. | H2CO3的酸性比H3BO3的酸性弱 | D. | Cl-、Br-、I-的还原性依次减弱 |
分析 A.电子层越多,原子半径越大;同周期原子序数大的原子半径小;
B.金属性越强,对应最高价氧化物的水化物碱性越强;
C.非金属性越强,对应最高价氧化物的水化物酸性越强;
D.非金属性越强,对应阴离子的还原性越弱.
解答 解:A.电子层越多,原子半径越大;同周期原子序数大的原子半径小,则O、S、Na的原子半径依次增大,故A正确;
B.金属性越强,对应最高价氧化物的水化物碱性越强,则LiOH、KOH、CsOH的碱性依次增强,故B错误;
C.非金属性越强,对应最高价氧化物的水化物酸性越强,则H2CO3的酸性比H3BO3的酸性强,故C错误;
D.非金属性越强,对应阴离子的还原性越弱,则Cl-、Br-、I-的还原性依次增强,故D错误;
故选A.
点评 本题考查元素周期律和元素周期表,为高频考点,把握元素的位置、性质、元素周期律为解答的关键,侧重分析与应用能力的考查,注意规律性知识的综合应用,题目难度不大.


科目:高中化学 来源: 题型:多选题
 >H2CO3>
>H2CO3>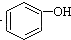 ,将
,将 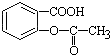 转变为
转变为 的方法是( )
的方法是( )| A. | 与足量的NaOH溶液共热,再通入CO2 | |
| B. | 与稀H2SO4共热后,加入足量的NaOH溶液 | |
| C. | 加热溶液,通入足量的CO2 | |
| D. | 与稀H2SO4共热后,加入足量的NaHCO3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 卤代烃在NaOH的醇溶液中共热均能发生消去反应生成烯烃 | |
| B. | 凡是能发生银镜反应的物质都属于醛类 | |
| C. | 能与FeCl3溶液作用显紫色的有机物一般含有酚羟基 | |
| D. | 酯类水解均能生成含相同碳原子数的羧酸和醇 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硝酸银与氯化钾溶液的反应:Ag++Cl-═AgCl↓ | |
| B. | 硝酸与氢氧化钠溶液的反应:H++OH-═H2O | |
| C. | 碳酸钙与盐酸的反应:CO32-+2H+═CO2↑+H2O | |
| D. | 锌粒与稀硫酸的反应:Zn+2H+═Zn2++H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 KMnO4是锰的重要化合物,它是一种良好的氧化剂,用来漂白毛、棉和丝,或使油类脱色.其制备方法如下:
KMnO4是锰的重要化合物,它是一种良好的氧化剂,用来漂白毛、棉和丝,或使油类脱色.其制备方法如下: 2KMnO4+2KOH+H2↑.在整个制备流程中可循环利用的物质是氢氧化钾(写名称).
2KMnO4+2KOH+H2↑.在整个制备流程中可循环利用的物质是氢氧化钾(写名称).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 ,已知甲苯的一氯代物有4种,则甲苯完全氢化后的环烷烃的一氯代物有( )
,已知甲苯的一氯代物有4种,则甲苯完全氢化后的环烷烃的一氯代物有( )| A. | 3种 | B. | 4种 | C. | 5种 | D. | 6种 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硅太阳能电池、计算机芯片、光导纤维都用到硅单质 | |
| B. | 水晶镜片、石英钟表、玛瑙手镯含有SiO2 | |
| C. | 水泥路桥、门窗玻璃、砖瓦、陶瓷餐具所用材料为硅酸盐 | |
| D. | 熔融烧碱时不能使用普通玻璃坩埚、石英坩埚和陶瓷坩埚 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com