
| ���ܴ������е������� | H+ NH4+ Al3+ K+ |
| ���ܴ������е������� | Cl- Br- I? ClO? AlO2- |
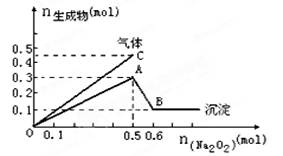
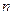 �������NaOH��Һ�������
�������NaOH��Һ�������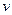 ���Ĺ�ϵ����ͼ��ʾ��
���Ĺ�ϵ����ͼ��ʾ��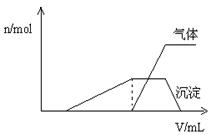
 __ ___ __��
__ ___ __�� Cl�� ��Br����I��������1 L�û����Һ��ͨ��һ������Cl2����Һ��Cl����Br����I�������ʵ�����ͨ��Cl2�������״�����Ĺ�ϵ���±���ʾ��������ش��������⣺
Cl�� ��Br����I��������1 L�û����Һ��ͨ��һ������Cl2����Һ��Cl����Br����I�������ʵ�����ͨ��Cl2�������״�����Ĺ�ϵ���±���ʾ��������ش��������⣺| Cl2���������״���� | 2��8L | 5��6 L | 11��2 L |
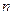 ��Cl���� ��Cl���� | 1��25mol | 1��5 mol | 2 mol |
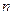 ��Br���� ��Br���� | 1��5 mol | 1��4 mol | 0��9 mol |
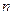 ��I���� ��I���� | 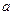 mol mol |  0 0 | 0 |

| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A��2��1��2 | B��1��2��2 | C��2��2��1 | D��9��2��4 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
 �Ÿ�ȡ���������Լ��ֱ����5֧�Թ��У�
�Ÿ�ȡ���������Լ��ֱ����5֧�Թ��У� ������������ˮ�����Թܣ��۲��� ����������ʵĻ�ѧʽ��
������������ˮ�����Թܣ��۲��� ����������ʵĻ�ѧʽ��  �Ʒֱ�ȡδ���Һ�������м��������Ѽ������Һ���۲쵽���������Ӧ�����ӷ���ʽ��
�Ʒֱ�ȡδ���Һ�������м��������Ѽ������Һ���۲쵽���������Ӧ�����ӷ���ʽ�� �������Թ����а�ɫ�������ɣ����ӷ���ʽ�� ��
�������Թ����а�ɫ�������ɣ����ӷ���ʽ�� �� �������Թ�������ɫ�������ɣ����ӷ���ʽ�� ��
�������Թ�������ɫ�������ɣ����ӷ���ʽ�� ���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
 ����Һ�����Cʱ�����а�ɫ��������.
����Һ�����Cʱ�����а�ɫ��������.�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ�������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
 ����
���� ����
���� ����HF����
����HF����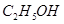 ����
����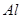 ����ʳ��ˮ����
����ʳ��ˮ����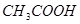
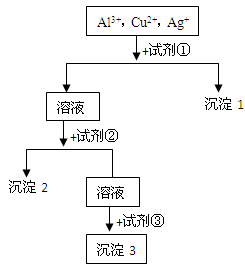
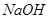 ��Һ��Ӧ����_____________��
��Һ��Ӧ����_____________��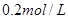 ��ij����Һ������Ϊ���ᡢ���ᡢ�����е�һ�֣�Ϊ��ȷ��������Һ����ɽ���ʵ�飺ȡ
��ij����Һ������Ϊ���ᡢ���ᡢ�����е�һ�֣�Ϊ��ȷ��������Һ����ɽ���ʵ�飺ȡ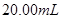 ����
���� ��Һ����μ���
��Һ����μ���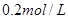 ������������Һ��ǡ�÷�Ӧ��ȫʱ�����Һ���Ϊ
������������Һ��ǡ�÷�Ӧ��ȫʱ�����Һ���Ϊ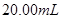 �����û�ѧ����ش�
�����û�ѧ����ش� _______________��
_______________��| ������ | 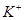 �� ��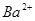 �� ��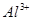 �� ��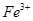 |
| ������ | 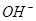 �� �� �� ��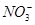 �� ��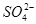 |
 ���£�
���£��鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
 Mn��CN��2 + ��CN��2�� + 2H2O
Mn��CN��2 + ��CN��2�� + 2H2O KI + ��CN��2
KI + ��CN��2 +fCO32��+bCl��+cH2O��������ѧ����ʽ���ܵ���ƽϵ���ж��飬��ش�
+fCO32��+bCl��+cH2O��������ѧ����ʽ���ܵ���ƽϵ���ж��飬��ش� ��1/2 C��2 D����
��1/2 C��2 D���� ��ȷ��
��ȷ���鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com