
【题目】侯氏制碱法制备碳酸氢钠的原理为NH3+H2O+CO2 +NaCl=NH4Cl+NaHCO3↓,某化学小组用如图装置在实验室中模拟该制备过程,下列说法不正确的是
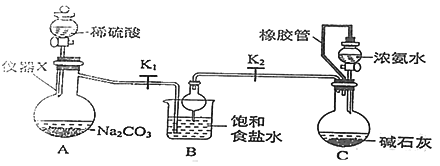
A. 装置A中仪器X的名称为蒸馏烧瓶
B. 装置B中球形干燥管的作用是防止倒吸
C. 装置C中橡胶管的作用是平衡压强,使溶液顺利滴下
D. 实验开始后,应先打开K1一段时间,然后再打开K2
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】(一)在密闭容器中,保持一定温度进行如下反应:N2(g)+3H2(g) ![]() 2NH3(g),已知加入1 mol N2和3 mol H2,在恒压条件下达到平衡时生成a mol NH3,在恒容条件下达到平衡时生成b mol NH3,回答下列问题:
2NH3(g),已知加入1 mol N2和3 mol H2,在恒压条件下达到平衡时生成a mol NH3,在恒容条件下达到平衡时生成b mol NH3,回答下列问题:
(1)写出该反应的化学平衡常数表达式:K=___________。
(2)平衡常数K值越大,表明建立平衡时___________(填序号)。
A. N2的转化率越高 B. NH3的产量越大
C. 正反应进行得越彻底 D. 化学反应速度越快
(3)a与b的关系是:a ____ b(填>、<、=)
(二)在密闭容器中发生下列反应: I2(g)+H2(g)![]() 2HI(g)(正反应吸热)
2HI(g)(正反应吸热)
起始时,n(H2)=a mol,n(I2)=b mol。只改变表中列出的条件,其他条件不变,试将化学反应速率的改变(“增大”“减小”或“不变”)填入相应的表格。
编号 | 反应条件 | 反应速率 |
① | 升高温度 | ______ |
② | 再充入a mol H2 | _______ |
③ | 将容器容积扩大为原来2倍 | _______ |
④ | 容积不变通入b mol Ne(g) | _______ |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业制法获得的纯碱中常含有NaCl杂质,用下述方法可以测定样品中NaCl的质量分数。
样品12.0 g ![]() 溶液
溶液![]() 沉淀
沉淀![]() 固体19.7 g
固体19.7 g
(1)如何检验氯化钡溶液已过量____________
(2)检验沉淀是否洗涤干净所用到的试剂是____________
(3)样品中Na2CO3的质量分数为_________(小数点后保留1位)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有下列物质
①NaCO310H2O 晶体 ②铜 ③浓硫酸 ④CO2 ⑤NaHSO4 固体 ⑥Ba(OH)2 固体 ⑦红褐色的 氢氧化铁胶体 ⑧氨水 ⑨稀硝酸 ⑩Al2(SO4)3
(1)上述物质属于强电解质的有___________________(填编号)。
(2)上述物质中有两种在水溶液中可发生离子反应:H+ +OH﹣=H2O,写出对应的化学方程式___________________________________。
(3)⑩可以作净水剂,请用离子方程式解释其原因_____________。17.1g的⑩溶于水配成 250mL 溶液,![]() 的物质的量浓度为______________。
的物质的量浓度为______________。
(4)将⑥的溶液滴加到⑤的溶液中至恰好沉淀,发生反应的离子方程式_____________________。
(5)②与⑨发生反应的化学方程式为 ![]() 。当有0.6mol电子转移时,生成的气体标准状况下的体积为________L。
。当有0.6mol电子转移时,生成的气体标准状况下的体积为________L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应NH4Cl+NaNO2![]() NaCl+N2↑+2H2O放热且产生气体,可用于冬天石油开采。下列表示反应中相关微粒的化学用语正确的是
NaCl+N2↑+2H2O放热且产生气体,可用于冬天石油开采。下列表示反应中相关微粒的化学用语正确的是
A. 中子数为18的氯原子:![]()
B. N2的结构式:N=N
C. Na+的结构示意图: 
D. H2O的电子式: ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为元素周期表的一部分,请参照元素①~⑧在表中位置,用化学用语回答下列问题:
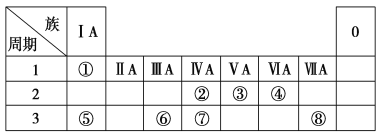
(1)④、⑤、⑥的原子半径由大到小的顺序是________。
(2)②、③、⑦的最高价含氧酸的酸性由强到弱的顺序是_____________。
(3)①、④、⑤、⑧中的某些元素可形成既含离子键又含极性共价键的化合物,写出其中一种具有漂白性的化合物的电子式:________。
(4)由表中两种元素的原子按1∶1组成的常见液态化合物的稀溶液易被催化分解,可使用的催化剂为(填序号)________。
a.MnO2 b.KMnO4 c.Na2SO3 d.Fe2(SO4)3
(5)用电子式表示①与③组成的最简单的化合物的形成过程:_________________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学——选修3:物质结构与性质]
锌在工业中有重要作用,也是人体必需的微量元素。回答下列问题:
(1)Zn原子核外电子排布式为________________。
(2)黄铜是人类最早使用的合金之一,主要由Zn和Cu组成。第一电离能Ⅰ1(Zn)_______Ⅰ1(Cu)(填“大于”或“小于”)。原因是________________。
(3)ZnF2具有较高的熔点(872 ℃),其化学键类型是_________;ZnF2不溶于有机溶剂而ZnCl2、ZnBr2、ZnI2能够溶于乙醇、乙醚等有机溶剂,原因是________________。
(4)《中华本草》等中医典籍中,记载了炉甘石(ZnCO3)入药,可用于治疗皮肤炎症或表面创伤。ZnCO3中,阴离子空间构型为________________,C原子的杂化形式为________________。
(5)金属Zn晶体中的原子堆积方式如图所示,这种堆积方式称为_______________。六棱柱底边边长为a cm,高为c cm,阿伏加德罗常数的值为NA,Zn的密度为________________g·cm-3(列出计算式)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向一定量的Fe、FeO、Fe3O4的混合物中加入100mL2mol/L的盐酸,恰好使混合物完全溶解,放出224mL(标准状况)的气体,所得溶液中加入KSCN溶液无血红色出现。若用足量的CO在高温下还原相同质量的此混合物,能得到铁的质量是( )
A. 11.2gB. 5.6gC. 2.8gD. 无法计算
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)标准状况下11.2L,由CO和H2组成的混合气体的质量为7.2g,则混合气体的平均摩尔质量为___;此混合气体完全燃烧,将燃烧产物通过足量过氧化钠后,固体增重___g。
(2)若分别用①KMnO4(还原产物是Mn2+)②MnO2(还原产物是Mn2+)③Ca(ClO)2(还原产物是Cl2)氧化浓盐酸制备氯气,当浓盐酸足量且这三种氧化剂的物质的量相同时,生成氯气的物质的量最少的是___。(填序号)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com