
【题目】根据要求回答问题:
(1)相同温度下等物浓度的下列溶液中. A.NH4Cl B.NH4HCO3 C.NH4HSO4 D.(NH4)2SO4
①pH值由大到小的顺序是(用对应的字母填写).
②NH4+离子浓度由大到小的顺序是(用对应的字母填写).
③若上述溶液的pH值相同,则其物成的量浓度关系是(用对应的字母填写).
(2)25℃.向50mL 0.018molL﹣1 的 AgNO3溶液中加入50mL 0.020molL﹣1的盐酸,生成沉淀.己知该温度下AgCl的Ksp=1.0×10﹣10 , 忽略溶液的体积变化,请计算: ①完全沉淀后,溶液中c(Ag+)= .
②完全沉淀后,溶液的pH= .
(3)弱酸及其盐在水中存在多种平衡关系.己知NaA水溶液呈碱性,常温下将0.1molNaA和0.05molHCl溶于水,得到1L溶液. ①己知该混合溶液为弱酸性,则溶液中离子浓度由大到小的顺序为 .
②向该混合物中再加0.03molNaOH,溶液中n(A﹣)+n(OH﹣)﹣n(H+)= .
【答案】
(1)B>A>D>C; D>C>A>B; C<D<A<B
(2)1.0×10﹣7mol/L;2
(3)c(Na+)>c(A﹣)>c(Cl﹣)>c(H+)>c(OH﹣);0.08
【解析】解:A.铵根离子水解,溶液呈酸性,B.碳酸氢根离子促进铵根离子水解,酸性较氯化铵溶液酸性弱,C.电离出氢离子,并抑制铵根离子水解,显强酸性,D.铵根离子水解,水解程度不大,铵根离子浓度最大,酸性比氯化铵溶液的酸性强.
①pH值由大到小的顺序是:B>A>D>C,所以答案是:B>A>D>C;
②NH4+离子浓度由大到小的顺序是:D>C>A>B,所以答案是:D>C>A>B;
③相同温度下,相同物质的量浓度的上述溶液pH值由大到小的顺序是:B>A>D>C,若上述溶液的pH值相同,则其物成的量浓度关系应是C<D<A<B,所以答案是:C<D<A<B;(2)①向50ml0.018mol/L的AgNO3溶液中加入50ml0.02mol/L的盐酸,混合后两者浓度分别为c(Ag+)= ![]() mol/L=0.009 mol/L、c(Cl﹣)=
mol/L=0.009 mol/L、c(Cl﹣)= ![]() mol/L=0.01mol/L,Ag+与Cl﹣是等物质的量反应的,此时Cl﹣过量,过量浓度c(Cl﹣)=0.01mol/L﹣0.009mol/L=0.001mol/L,
mol/L=0.01mol/L,Ag+与Cl﹣是等物质的量反应的,此时Cl﹣过量,过量浓度c(Cl﹣)=0.01mol/L﹣0.009mol/L=0.001mol/L,
Ksp=c(Ag+)×C(Cl﹣)=1.0×10﹣10,则:c(Ag+)= ![]() mol/L=1.0×10﹣7mol/L,
mol/L=1.0×10﹣7mol/L,
所以答案是:1.0×10﹣7mol/L;
②沉淀生成后,氢离子浓度c= ![]() =0.01mol/L,所以pH=2,
=0.01mol/L,所以pH=2,
所以答案是:2;(3)①常温下将0.10mol NaA和0.05mol HCl溶于水,得到1L溶液,得到的溶液中含有0.05molNaA、0.05molHA、0.05molNaCl;溶液的pH<7,说明溶液呈酸性,同浓度溶液中HA电离大于A﹣离子的水解,c(A﹣)>c(Cl﹣)、c(H+)>c(OH﹣),则溶液中离子浓度大小为:c(Na+)>c(A﹣)>c(Cl﹣)>c(H+)>c(OH﹣),
所以答案是:c(Na+)>c(A﹣)>c(Cl﹣)>c(H+)>c(OH﹣);
②根据混合液中电荷守恒可得:n(A﹣)+n(OH﹣)+c(Cl﹣)=c(Na+)+n(H+),则n(A﹣)+n(OH﹣)﹣n(H+)=c(Na+)﹣c(Cl﹣)=0.03mol+0.10nol﹣0.05mol=0.08mol,
所以答案是:0.08.
【考点精析】通过灵活运用弱电解质在水溶液中的电离平衡,掌握当弱电解质分子离解成离子的速率等于结合成分子的速率时,弱电解质的电离就处于电离平衡状态;电离平衡是化学平衡的一种,同样具有化学平衡的特征.条件改变时平衡移动的规律符合勒沙特列原理即可以解答此题.


 智慧课堂密卷100分单元过关检测系列答案
智慧课堂密卷100分单元过关检测系列答案 单元期中期末卷系列答案
单元期中期末卷系列答案科目:高中化学 来源: 题型:
【题目】某混合物浆液含Al(OH)3、MnO2和少量Na2CrO4。考虑到胶体的吸附作用使Na2CrO4不易完全被水浸出,某研究小组利用设计的电解分离装置(见图2),使浆液分离成固体混合物和含铬元素溶液,并回收利用。回答Ⅰ和Ⅱ中的问题。
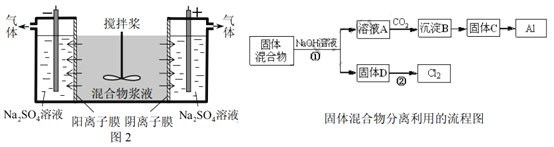
Ⅰ.固体混合物的分离和利用(流程图中的部分分离操作和反应条件未标明)
(1)反应①所加试剂NaOH的电子式为_________,B→C的反应条件为__________,C→Al的制备方法称为______________。
(2)该小组探究反应②发生的条件。D与浓盐酸混合,不加热,无变化;加热有Cl2生成,当反应停止后,固体有剩余,此时滴加硫酸,又产生Cl2。由此判断影响该反应有效进行的因素有(填序号)___________。
a.温度 b.Cl-的浓度 c.溶液的酸度
(3)0.1 mol Cl2与焦炭、TiO2完全反应,生成一种还原性气体和一种易水解成TiO2·xH2O的液态化合物,放热4.28 kJ,该反应的热化学方程式为__________。
Ⅱ.含铬元素溶液的分离和利用
(4)用惰性电极电解时,CrO42-能从浆液中分离出来的原因是__________,分离后含铬元素的粒子是_________;阴极室生成的物质为___________(写化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,将0.1mol/L的一元酸HA溶液逐滴滴加到10mL0.1mol/LNaOH溶液中,pH的变化曲线如图所示。下列说法错误的是( )

A. 一元酸HA为弱酸
B. a点所示溶液中c(Na+)>c(A-)>c(OH-)>c(HA)
C. pH=7时,c(Na+)>c(A-)+c(HA)
D. b点所示溶液中c(H+)-c(OH-)=1/2[c(A-)-c(HA)]
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用铬铁矿(主要成分可表示为FeO·Cr2O3,还含有Al2O3、MgCO3、SiO2等杂质)为原料制备重铬酸钾晶体(K2Cr2O7)和铁红的流程如下:
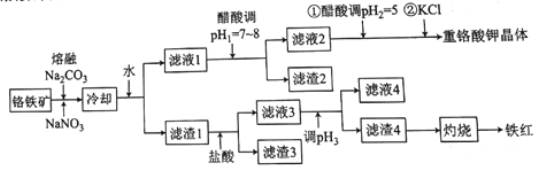
已知:I.常见离子开始生成沉淀和沉淀完全的pH如下表所示:
Fe3+ | Al3+ | Mg2+ | SiO32- | AlO2- | |
开始沉淀的pH | 1.9 | 4.2 | 8.1 | 9.5 | 10.2 |
沉淀完全的pH | 3.2 | 5.3 | 9.4 | 8.0 | 8.5 |
II.熔融Na2CO3条件下主要发生反应:
2FeO·Cr2O3+4Na2CO3+7NaNO3=4Na2CrO4+Fe2O3+4CO2↑+7NaNO2。
(1)熔融Na2CO3条件下还可以得到的副产物为NaAlO2和Na2SiO3,生成这两种副产物的化学方程式为___________________。
(2)滤渣2的主要成分为________(填化学式)。
(3)用醋酸调节pH2=5的目的为__________;若调节的pH过低,NO2-可被氧化为NO3-,其离子方程式为______________。
(4)调节pH2后,加入KCl控制一定条件,可析出K2Cr2O7晶体的可能理由是_______。
(5)调节pH3的范围为______。
(6)检验滤液4中Fe3+是否沉淀完全的方法是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从KNO3和少量NaCl杂质的混合物中提纯KNO3 . 涉及的操作依次有:①溶解、②过滤、③结晶、④冷却、⑤蒸发浓缩.其中合理的是( )
A.①②③④⑤
B.①③⑤④②
C.①⑤④③②
D.①②⑤③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据要求填空:
(1)①常温下,.某溶液中由水电离出的c(OH﹣)=1.0×10﹣10mol/L,该溶液可以是 . (填选项)
A.pH=4的CH3COOH
B.pH=10的NaOH
C.pH=9的 Na2CO3
D.pH=2的 H2SO4
E.pH=4的 NH4Cl
(2)在100℃时,将 100mL 0.1mol/L 的稀H2SO4溶液与 100mL 0.4mol/L的NaOH 溶液混合后,溶液的pH= . (混合时溶液体积变化忽略不计,己知Kw=10﹣12).
(3)常温下,amL0.1mol/L盐酸与bmL0.1mol/L氨水混合,充分反应,若混合后溶液呈中性,则ab (填“<”、“>”或“=”).
(4)常温下,amLpH=3的盐酸与bmLpH=11的氨水混合,充分反应,若a=b,则反应后溶液中离子浓度从大到小的顺序是 .
(5)氯化铝水溶液呈酸性,原因是(用离子方程式表示>: . 把AlCl3溶液蒸干,灼烧,最后得到的主要固体产物是 .
(6)25℃,在0.10mol/LH2S溶液中,通入HCl气体或加入NaOH固体以调节溶液pH,溶液pH与c(S2﹣)关系如下图(忽略溶液体积的变化、H2S的挥发). ①pH=13时,溶液中的 c(H2S)+c(HS﹣)=mol/L.
②某溶液含 0.020mol/LMn2+、0.10mol/LH2S,当溶液pH=时,Mn2+开始沉淀.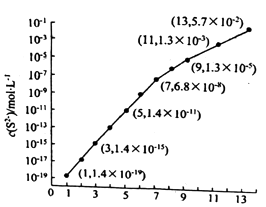
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关化学用语表示正确的是
A. 乙烯的比例模型:![]() B. S2-的结构示意图:
B. S2-的结构示意图:![]()
C. KCl的电子式:![]() D. 丙烯的结构简式:CH3CH=CH2
D. 丙烯的结构简式:CH3CH=CH2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定体积的容器中加入1.5mol氙气和7.5mol氟气,于400℃和2633Kpa压强下加热数小时,然后迅速冷至25℃,容器内除得到一种无色晶体外,还余下4.5mol氟气。则所得无色晶体产物中,氙和氟的原子个数之比是 ( )
A.1 :6B.1 :4C.1 :3D.1 :2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:⑴Zn(s)+ ![]() O2(g)=ZnO(s),△H=﹣350kJmol﹣1 , ⑵2Ag(s)+
O2(g)=ZnO(s),△H=﹣350kJmol﹣1 , ⑵2Ag(s)+ ![]() O2(g)=Ag2O(s),△H=﹣25kJmol﹣1 ,
O2(g)=Ag2O(s),△H=﹣25kJmol﹣1 ,
则Zn(s)+Ag2O(s)=ZnO(s)+2Ag(s)的△H等于( )
A.﹣375 kJmol﹣1
B.﹣325 kJmol﹣1
C.+375 kJmol﹣1
D.+325 kJmol﹣1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com