
【题目】下列设计的实验方案能达到实验目的是

A. 制备Fe(OH)2:用图1所示装置,向试管中加入NaOH溶液,振荡
B. 测定H2的生成速率:用图2所示装置,制取一定体积的H2,记录时间
C. 除去苯中少量苯酚:向苯和苯酚的混合液中加入浓溴水,过滤
D. 检验淀粉是否水解:取0.5 g淀粉于洁净的试管中,先加入5 mL稀硫酸,水浴加热,一段时间后再加入少量新制氢氧化铜悬浊液,水浴加热,观察实验现象
【答案】B
【解析】A,从试管口向硫酸亚铁溶液中滴加氢氧化钠溶液时,会把空气中的氧气带入溶液中将生成的氢氧化亚铁氧化,振荡时又会加快氧化的过程,所以不能用些法制备氢氧化亚铁,A错。B,当稀硫酸与锌反应生成氢气后,锥形瓶中的气体进入注射器,可以记录收集到一定价格体积的气体所用的时间,计算出单位时间内生成氢气的体积作为氢气的生成速率。用这种方法可以比较不同活泼金属与酸反应生成氢气的快慢,所以B正确。C,向苯和苯酚的混合液中加入浓溴水,溴与苯酚反应生成的三溴苯酚会溶解在苯中,无法过滤除去,C错。D,检验淀粉是否水解,就是检验有没有葡萄糖生成。检验葡萄糖所用的新制的氢氧化铜悬浊液是碱性的,必须先用氢氧化钠中和淀粉水解时所加入的催化剂稀硫酸。D实验中没加氢氧化钠,所D错了。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】德国化学家凯库勒认为苯分子的结构中,碳碳间以单、双键交替结合而成环状。 为了评价凯库勒的观点,某学生设计了以下实验方案:

实验操作:
①按上图所示的装置图连接好各仪器;
②检验装置的气密性;
③在 A 中加入适量的苯和液溴的混合液体,再加入少量铁粉,塞上橡皮塞,打开 K1、K2止水夹,关闭 K3 止水夹;
④待烧瓶 C 中气体收集满后,将导管 b 的下端插入烧杯里的水中,关闭 K2,打开 K3,挤 压预先装有水的胶头滴管的胶头,观察实验现象。
请回答下列问题:
(1)实验室可用 MnO2、NaBr 和浓硫酸混合共热制取单质溴,其中 MnO2 作氧化剂。写 出该反应的化学方程式:____。
(2)简述在实验操作步骤②中检验装置气密性的方法:_____________________;在实验过程中观察到装置 A 中有微沸现象,原因是_______________________。
(3)当 C 中观察到____,可证明凯库勒观点是错误的,以下 还可证明凯库勒观点错误的事实是________。
①6 个 C-H 键的长度相等
②6个碳碳键的长度都相等
③苯的一氯代物只有一种结构
④苯的邻二氯代物只有一种结构
⑤苯不能使酸性高锰酸钾溶液褪色
⑥苯不能使溴的四氯化碳溶液因加成而褪色
A.①②⑤⑥ B.②④⑤⑥ C.全部 D.①②③④⑤
(4)查阅文献:苯与液溴在 FeBr3 催化下的反应机理共分三步:
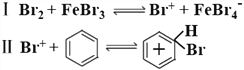
请完成第三步反应:Ⅲ____。
(5)将装置 A 内反应后的液体依次进行下列实验操作就可得到较纯净的溴苯:
①用蒸馏水洗涤,振荡,分液;②用 5%的 NaOH 溶液洗涤,振荡,分液;③用蒸馏水洗 涤,振荡,分液;④加人无水氯化钙干燥;⑤____(填操作名称)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素的电负性用来描述不同元素的原子对键合电子吸引力的大小。电负性应用:
判断元素的金属性和非金属性的强弱。下表列出了同周期的几种短周期元素的部分性质
请回答下列问题:

(l)写出D元素的离子结构示意图_______________;
(2)X的值应为____(填字母);
A.3.6 B.3.1 C.1.4 D.2.1
(3)分析表中数据,简述同周期元素(除惰性气体)电负性大小与原子半径的关系:________________________________;
(4)A、B、C三种元素形成的氢化物中,其稳定性由强到弱的顺序是:__________________
(用化学式表示)
(5)A、D最高价氧化物对应水化物相互反应的化学方程式:____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知15P、33As位于同一主族.下列关系正确的是( )
A.原子半径:As>Cl>P
B.非金属性:Cl>S>As
C.热稳定性:HCl>AsH3>PH3
D.酸性:H3AsO4>H2SO4>H3PO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值,下列叙述正确的是 ( )
A.常温常压下,22.4 L CCl4、CO2含有的分子数为1NA
B.常温常压下,1.06 g Na2CO3含有的Na+离子数为0.02NA
C.通常状况下,NA个CO2分子占有的体积约为22.4 L
D.物质的量浓度为0.5 mol/L的MgCl2溶液中,含有Cl-个数为1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】树脂交联程度决定了树脂的成膜性。下面是一种成膜性良好的醇酸型树脂的合成路线,如下图所示:

(1)合成A的化学方程式是__________。
(2)B的分子式为C4H7Br,且B不存在顺反异构,B的结构简式为_______,A到B步骤的反应类型是_________。
(3)E中含氧官能团的名称是______,D 的系统命名为_________。
(4)下列说法正确的是_______。
A.lmol化合物C最多消耗3molNaOH
B.lmol化合物E与足量银氨溶液反应产生2molAg
C. F不会与Cu(OH)2悬浊液反应
D.丁烷、1-丁醇、化合物D中沸点最高的是丁烷
(5)写出D、F在一定条件下生成醇酸型树脂的化学方程式__________。
(6) 的符合下列条件的同分异构体有_____种。
的符合下列条件的同分异构体有_____种。
① 苯的二取代衍生物;② 遇FeCl3溶液显紫色;③ 可发生消去反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三草酸合铁(Ⅲ)酸钾晶体(K3[Fe(C2O4)3]3H2O)有很重要的用途.可用如图流程来制备.根据题意完成下列各题:

(1)要从溶液中得到绿矾,必须进行的实验操作是 .(按前后顺序填写)
a.过滤洗涤 b.蒸发浓缩 c.冷却结晶 d.灼烧 e.干燥
某兴趣小组为测定三草酸合铁酸钾晶体(K3[Fe(C2O4)3]3H2O)中铁元素含量,做了如下实验:
步骤1:称量5.000g三草酸合铁酸钾晶体,配制成250ml溶液.
步骤2:取所配溶液25.00ml于锥形瓶中,加稀H2SO4酸化,滴加KMnO4溶液至草酸根恰好全部被氧化成二氧化碳,同时,MnO4﹣被还原成Mn2+.向反应后的溶液中加入一定量锌粉,加热至黄色刚好消失,过滤,洗涤,将过滤及洗涤所得溶液收集到锥形瓶中,此时,溶液仍里酸性.
步骤3:在酸性条件下,用0.010mol/L KMnO4溶液滴定步骤二所得溶液至终点,共做三次实验,平均消耗KMnO4溶液20.00ml,滴定中MnO4﹣,被还原成Mn2+.
(2)步骤1中,配制三草酸合铁酸钾溶液需要使用的玻璃仪器除烧杯、玻璃棒以外还有 ;
主要操作步骤依次是:称量、溶解、转移、 、定容、摇匀.
(3)步骤2中,加入锌粉的目的是 .
(4)步骤3中,发生反应的离子方程式为: .
(5)步骤2中,若加入的KMnO4的溶液的量不够,则测得的铁含量 .(选填“偏低”、“偏高”、“不变”)
(6)某同学将8.74g无水三草酸合铁酸钾(K3[Fe(C2O4)3])在一定条件下加热分解,所得固体的质量为5.42g,同时得到密度为1.647g/L(已折合成标准状况下)气体(是物质的量之比为4:5的混合气体).研究固体产物得知,铁元素不可能以三价形式存在,而盐只有K2CO3.写出该分解反应的化学方程式 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】PFS是水处理中重要的絮凝剂,下图是以回收的废铁屑为原料制备PFS的一种工艺流程。

(1)酸浸槽以及聚合釜中用到的酸应是__________;PFS中铁元素的化合价为__________;在酸浸槽中,为了提高浸出率,可以采取的措施有_________(写两条)。
(2)若废铁属含有较多铁锈(Fe2O3·xH2O),则酸浸时反应的化学方程式有_____________。
(3)如果反应釜中用H2O2作氧化剂,则反应的离子方程式为________;生产过程中,发现反应釜中产生了大量的气体,且温度明显升高,其原因可能是___________。
(4)聚合釜中溶液的pH必须控制在一定的范围内。如果溶液酸性过强,造成的后果是________。如果溶液酸性太弱又会生成大量的氢氧化铁沉淀。若溶液中Fe3+的浓度为1mol·L-1,当Fe3+开始沉淀时,涪液的pH约为_________。[已知Fe(OH)3的Ksp≈1.0×10-39]。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com