
| A. | 负极反应式为Mg-2e-═Mg2+ | |
| B. | 负极可能会发生副反应Mg+2H2O═Mg(OH)2+H2↑ | |
| C. | 电池放电时Cl-由负极向正极迁移 | |
| D. | 正极反应式为AgCl+e-═Ag+Cl- |
分析 Mg-AgCl电池中,活泼金属Mg是还原剂、AgCl是氧化剂,金属Mg作负极,正极反应为2AgCl+2e-═2Cl-+2Ag,负极反应式为Mg-2e-=Mg2+,以此解答该题.
解答 解:A.活泼金属镁作负极,失电子发生氧化反应,反应式为:Mg-2e-=Mg2+,故A正确;
B.镁为活泼金属,可与水反应,发生Mg+2H2O═Mg(OH)2+H2↑,故B正确;
C.原电池放电时,阴离子向负极移动,则Cl-在正极产生由正极向负极迁移,故C错误;
D.AgCl是难溶物,其电极反应式为:2AgCl+2e-═2Cl-+2Ag,故D正确.
故选C.
点评 本题考查原电池工作原理,为高频考点,侧重考查学生的分析能力,注意把握原电池的工作原理,把握常见物质的性质,如镁的还原性以及银离子的氧化性是解题的关键,题目难度中等.


 学业测评一课一测系列答案
学业测评一课一测系列答案科目:高中化学 来源: 题型:选择题
| A. | 2.4 g镁在空气中完全燃烧生成MgO和Mg3N2,转移的电子数为0.8 NA | |
| B. | 标准状况下,5.6 L二氧化碳气体中含有的氧原子数为0.5 NA | |
| C. | 8.7 g MnO2与40 mL 10 mol/L的浓盐酸充分反应,生成的氯气分子数为0.1 NA | |
| D. | 0.1 L 0.5 mol/L CH3COOH溶液中含有的氢离子数为0.05 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
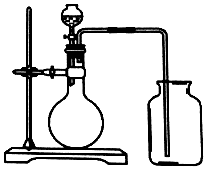
| A. | 锌和稀硫酸 | B. | 碳酸钙和硫酸 | ||
| C. | 过氧化氢和二氧化锰 | D. | 硫酸铵和氢氧化钠 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 2.2g | B. | 4.2g | C. | 4.4g | D. | 4.8g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 化学家可以在微观层面上操纵分子和原子,组装分子材料 | |
| B. | 化学是一门具有创造性的科学,化学的特征就是认识分子和制造分子 | |
| C. | 化学是在原子、分子的水平上研究物质的一门自然科学 | |
| D. | 化学注重理论分析、推理,而不需要做化学实验 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 强电解质都易溶于水,所以BaSO4是弱电解质 | |
| B. | 氨气的水溶液可以导电,但氨气属于非电解质 | |
| C. | 使用催化剂可以让不自发的化学反应自发进行 | |
| D. | 电解质溶液的导电过程属于物理变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2.24升 | B. | 3.36升 | C. | 4.48升 | D. | 5.6升 |
查看答案和解析>>
科目:高中化学 来源:2017届四川省高三上10月月考化学试卷(解析版) 题型:实验题
三氯化铬是化学合成中的常见物质,三氯化铬易升华,在高温下能被氧气氧化,碱性条件下能被H2O2氧化为Cr(Ⅵ)。制三氯化铬的流程如下:
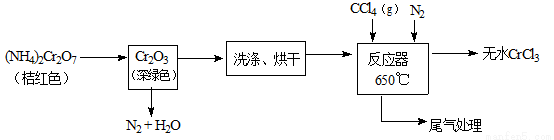
(1)重铬酸铵分解产生的三氧化二铬(Cr2O3难溶于水)需用蒸馏水洗涤的原因 ,如何用简单方法判断其已洗涤干净 。
(2)已知CCl4沸点为57.6℃,为保证稳定的CCl4气流,应采用的措施是 。
(3)用下图装置制备CrCl3时,主要步骤包括:

①将产物收集到蒸发皿中;②加热反应管至400℃,开始向三颈烧瓶中通人氮气,使CCl4蒸气经氮气载入反应室进行反应,继续升温到650℃;③三颈烧瓶中装入150mLCCl4,并加热CCl4,温度控制在50~60℃之间;④反应管出口端出现了CrCl3升华物时,切断加热管式炉的电源;⑤停止加热CCl4,继续通人氮气;⑥检查装置气密性。正确的顺序为:⑥→③→ 。
(4)已知反应管中发生的主要反应有:Cr2O3 + 3CCl4 → 2CrCl3 + 3COCl2,因光气剧毒,实验需在通风橱中进行,并用乙醇处理COCl2,生成一种含氧酸酯(C5H10O3),用乙醇处理尾气的化学方程式为 。
(5)样品中三氯化铬质量分数的测定:
称取样品0.3300g,加水溶解并定容于250mL容量瓶中。移取25.00mL于碘量瓶(一种带塞的锥形瓶)中,加热至沸后加入1gNa2O2,充分加热煮沸,适当稀释,然后加入过量的2mol/LH2SO4至溶液呈强酸性,此时铬以Cr2O 存在,再加入1.1gKI,密塞,摇匀,于暗处静置5分钟后,加入1mL指示剂,用0.0250mol/L硫代硫酸钠溶液滴定至终点,平行测定三次,平均消耗标准硫代硫酸钠溶液24.00mL。
存在,再加入1.1gKI,密塞,摇匀,于暗处静置5分钟后,加入1mL指示剂,用0.0250mol/L硫代硫酸钠溶液滴定至终点,平行测定三次,平均消耗标准硫代硫酸钠溶液24.00mL。
已知:Cr2O72-+6I-+14H+=2Cr3++3I2+7H2O,2Na2S2O3+I2===Na2S4O6+2NaI。
①实验可选用的指示剂名称为 。
②移入碘量瓶的CrCl3溶液需加热煮沸,加入Na2O2后也要加热煮沸,其主要原因是 。
③样品中无水三氯化铬的质量分数为_____________________.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com