
| A. | CCl4的电子式 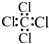 | B. | 苯的分子比例模型  | ||
| C. | 乙烯的结构式 CH2=CH2 | D. | 纤维素的分子式 C6H10O5 |
分析 A、四氯化碳中碳原子和氯原子均满足8电子稳定结构;
B、比例模型中可体现原子的相对大小,C原子比H原子大;
C、结构式中单键、双键不能省略;
D、纤维素为多糖,属于高分子化合物.
解答 解;A、四氯化碳中碳原子和氯原子均满足8电子稳定结构,电子式为: ,故A错误;
,故A错误;
B、比例模型中可提现原子的相对大小,C原子比H原子大,苯的分子比例模型为 ,故B正确;
,故B正确;
C、结构式中单键、双键不能省略,CH2=CH2为结构简式,故C错误;
D、纤维素为多糖,属于高分子化合物,其分子式为(C6H10O5)n,故D错误;
故选B.
点评 本题考查化学用语,涉及电子式、结构式、分子式、比例模型等,注意化学用语的区别及规范应用,注重基础知识的考查,选项A中结构式与结构简式为易错点,题目难度不大.


 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案科目:高中化学 来源: 题型:选择题
| A. | Na、Mg、Al的还原性依次增强 | |
| B. | HF、HCl、HBr的热稳定性依次增强 | |
| C. | H3PO4、H2SO4、HClO4的酸性依次增强 | |
| D. | LiOH、NaOH、KOH、CsOH的碱性依次减弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Al2O3熔点很高,工业上还可采用电解熔融AlCl3的方法冶炼Al | |
| B. | 灼烧某物质时,用眼直接观察到火焰呈黄色,则可判断该物质不含钾元素 | |
| C. | 向新制的FeSO4溶液中滴入适量的NaOH溶液,放置片刻,整个反应过程的颜色变化是:浅绿色溶液→白色沉淀→灰绿色沉淀→红褐色沉淀 | |
| D. | 称取等质量的两份铝粉,分别加入过量的稀HCl和过量的NaOH溶液中,则放出氢气的体积(同温同压下)不相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
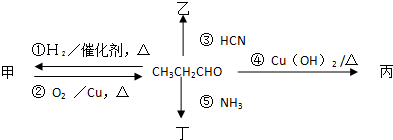
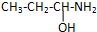
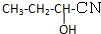
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 单质氧化性逐渐增强 | B. | 单质的熔沸点逐渐降低 | ||
| C. | 卤素离子的还原性逐渐增强 | D. | 气态氢化物稳定性逐渐增强 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2F2+2H2O═4HF+O2 | |
| B. | 2CH3COOH+Ca(ClO)2═2HClO+Ca(CH3COO)2 | |
| C. | I2+2NaClO3═2NaIO3+Cl2 | |
| D. | 4HCl+MnO2═MnCl2+Cl2↑+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
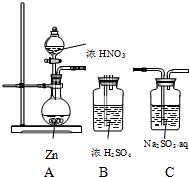 甲同学探究NO2的氧化性;设计了如下实验装置:
甲同学探究NO2的氧化性;设计了如下实验装置:| 步骤 | 现象 | 结论 |
| 取少量C中反应后的溶液 置于试管中, 先加入盐酸溶液酸化,再加入 氯化钡溶液 | 有白色沉淀产生 | NO2具有氧化性 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com