
| A. | 钠与水反应:Na+2H2O═Na++2OH-+H2↑ | |
| B. | 次氯酸钠溶液与醋酸溶液混合:ClO-+H+═HClO | |
| C. | Al片溶于NaOH溶液中,产生气体:2Al+2OH-+2H2O═2AlO2-+3H2↑ | |
| D. | 浓硝酸中加入过量铁粉并加热:Fe+3NO3-+6H+ $\frac{\underline{\;\;△\;\;}}{\;}$ Fe3++3NO2↑+3H2O |
分析 A.根据电荷守恒判断,离子方程式两边正电荷不相等;
B.醋酸为弱酸,离子方程式中醋酸不能拆开;
C.铝与氢氧化钠溶液反应生成偏铝酸钠和氢气;
D.铁粉过量,反应生成硝酸亚铁.
解答 解:A.钠与水反应生成氢氧化钠和氢气,正确的离子方程式为:2Na+2H2O═2Na++2OH-+H2↑,故A错误;
B.次氯酸钠溶液与醋酸溶液混合,醋酸需要保留分子式,正确的离子方程式为:ClO-+CH3COOH═HClO+CH3COO-,故B错误;
C.Al片溶于NaOH溶液中,反应生成偏铝酸钠和氢气,反应的离子方程式为:2Al+2OH-+2H2O═2AlO2-+3H2↑,故C正确;
D.浓硝酸中加入过量铁粉并加热,反应生成亚铁离子,正确的离子方程式为:Fe+2NO3-+4H+ $\frac{\underline{\;\;△\;\;}}{\;}$ Fe2++2NO2↑+2H2O,故D错误;
故选C.
点评 本题考查了离子方程式的书写判断,题目难度中等,注意熟练掌握离子方程式的书写原则,明确发生反应的实质为解答关键,试题培养了学生的分析能力及灵活应用基础知识的能力.


科目:高中化学 来源: 题型:选择题
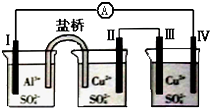
| A. | 电极Ⅱ逐渐溶解 | B. | 电极Ⅰ发生氧化反应 | ||
| C. | 电流方向:电极Ⅰ→A→电极Ⅳ | D. | 电极Ⅲ的电极反应:Cu2++2e-=Cu |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,1mol戊与过量盐酸反应的离子方程式是N2H4+2H+═N2H62+ 戊在氧化还原反应中与H2O2相似,既可作氧化剂,又可作还原剂,根据价态分析产生这种情况的原因是N2H4中氮元素的化合价为-2价,既可以升高,又可以降低;8g液态戊与液态双氧水恰好完全反应,产生两种无毒又不污染环境的气态物质,放出375kJ的热量,写出该反应的热化学方程式N2H4(l)+2H2O2(l)═N2(g)+4H2O(g)△H=-1 500 kJ/mol.
,1mol戊与过量盐酸反应的离子方程式是N2H4+2H+═N2H62+ 戊在氧化还原反应中与H2O2相似,既可作氧化剂,又可作还原剂,根据价态分析产生这种情况的原因是N2H4中氮元素的化合价为-2价,既可以升高,又可以降低;8g液态戊与液态双氧水恰好完全反应,产生两种无毒又不污染环境的气态物质,放出375kJ的热量,写出该反应的热化学方程式N2H4(l)+2H2O2(l)═N2(g)+4H2O(g)△H=-1 500 kJ/mol.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 工业上通过电解氯化钠溶液制取金属钠 | |
| B. | 金属镁在空气燃烧后的产物除MgO外,还有Mg3N2和C等 | |
| C. | 钠钾合金可在快中子反应堆中作热交换剂 | |
| D. | 钠可用于从钛、铌等金属的氯化物中置换出金属单质 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.0025 mol•L-1 | B. | 0.0001mol•L-1 | C. | 0.001mol•L-1 | D. | 0.005mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加碘食盐中加入的是KIO3 | |
| B. | 常用于杀菌消毒的84消毒液的主要成份是NaClO | |
| C. | CO、NO、NO2都是大气污染气体,在空气中都能稳定存在 | |
| D. | 变色眼镜和照相器材的生产都可能要用到溴化银 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com