
| A. | n(Na+):n(Cl-)可能为7:3 | |
| B. | 与NaOH反应的氯气一定为0.3mol | |
| C. | 当转移电子为n mol时,则0.15<n<0.25 | |
| D. | n(NaCl):n(NaClO):n(NaClO3)可能为6:1:1 |
分析 A.根据方程式Cl2+2NaOH=NaCl+NaClO+H2O、3Cl2+6NaOH=5NaCl+NaClO3+3H2O可知,氧化产物只有NaClO,n(Na+):n(Cl-)最大为2:1,当氧化产物为NaClO3,n(Na+):n(Cl-)最小为6:5;
B.由于反应后体系中没有NaOH,故氢氧化钠反应完,根据钠元素守恒n(NaOH)=n(NaCl)+n(NaClO)+n(NaClO3),再根据氯原子守恒有2n(Cl2)=n(NaCl)+n(NaClO)+n(NaClO3);
C.利用极限法解答,根据方程式Cl2+2NaOH=NaCl+NaClO+H2O、3Cl2+6NaOH=5NaCl+NaClO3+3H2O可知,氧化产物只有NaClO,转移电子数最少,氧化产物只有NaClO3,转移电子数最多;
D.令n(NaCl)=11mol,n(NaClO)=2mol,n(NaClO3)=1mol,根据电子转移守恒验证判断.
解答 解:A.根据方程式Cl2+2NaOH=NaCl+NaClO+H2O、3Cl2+6NaOH=5NaCl+NaClO3+3H2O可知,氧化产物只有NaClO,n(Na+):n(Cl-)最大为2:1,当氧化产物为NaClO3,n(Na+):n(Cl-)最小为6:5,故6:5<n(Na+):n(Cl-)<2:1,7:3>2:1,故A错误;
B.由于反应后体系中没有NaOH,故氢氧化钠反应完,根据钠元素守恒n(NaOH)=n(NaCl)+n(NaClO)+n(NaClO3)=0.03L×10mol/L=0.3mol,根据氯原子守恒有2n(Cl2)=n(NaCl)+n(NaClO)+n(NaClO3)=0.3mol,故参加反应的氯气n(Cl2)=0.15mol,故B错误;
C.根据方程式Cl2+2NaOH=NaCl+NaClO+H2O、3Cl2+6NaOH=5NaCl+NaClO3+3H2O可知,氧化产物只有NaClO,转移电子数最少,为0.3mol×$\frac{1}{2}$×1=0.15mol,氧化产物只有NaClO3,转移电子数最多,为0.3mol×$\frac{5}{6}$×1=0.25mol,则0.15<n<0.25,故C正确;
D.令n(NaCl)=6mol,n(NaClO)=1mol,n(NaClO3)=1mol,生成NaCl获得的电子为6mol×1=6mol,生成NaClO、NaClO3失去的电子为1mol×1+1mol×5=6mol,得失电子相等,故D正确;
故选CD.
点评 本题考查氧化还原反应的计算,为高频考点,把握发生的反应及电子、原子守恒为解答的关键,侧重分析与计算能力的考查,注意守恒法应用,题目难度不大.


科目:高中化学 来源: 题型:选择题
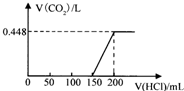 某混合溶液中含有NaOH与Na2CO3,向该溶液中逐滴加入稀盐酸至过量,生成的CO2(标准状况)与加入的盐酸体积有如图关系(不考虑CO2在水中的溶解).则该混合溶液中NaOH与Na2CO3物质的量之比为( )
某混合溶液中含有NaOH与Na2CO3,向该溶液中逐滴加入稀盐酸至过量,生成的CO2(标准状况)与加入的盐酸体积有如图关系(不考虑CO2在水中的溶解).则该混合溶液中NaOH与Na2CO3物质的量之比为( )| A. | 1:1 | B. | 2:1 | C. | 1:3 | D. | 3:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X与Y只能形成一种化合物 | |
| B. | 最高价氧化物对应水化物的酸性:N>M | |
| C. | 单质与水反应的剧烈程度:Z>Y | |
| D. | 气态氢化物稳定性:M>X |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
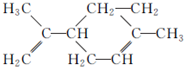 ,有关柠檬烯的说法正确的是( )
,有关柠檬烯的说法正确的是( )| A. | 柠檬烯分子为非极性分子 | |
| B. | 柠檬烯分子中所有碳原子处于同一个平面上 | |
| C. | 柠檬烯能与酸性高锰酸钾溶液发生取代反应 | |
| D. | 柠檬烯的分子式为C10H16,能使溴的四氯化碳溶液褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
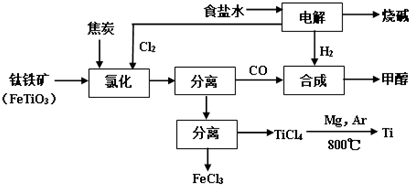
| 物质 | 沸点(℃) |
| TiCl4 | 136 |
| FeCl3 | 315 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| 选项 | 实验操作 | 现象 | 结论 |
| A | C2H4通入溴水中 | 溶液褪色 | C2H4跟Br2发生加成反应 |
| B | 向溶液X中滴入NaHCO3溶液 | 产生无色气体 | X中的溶质一定是酸 |
| C | Cl2通入品红溶液中 | 溶液褪色 | Cl2具有漂白性 |
| D | 分别向0.1mol•L-1醋酸和饱和硼酸溶液中滴加 0.1mol•L-1Na2CO3溶液 | 醋酸中有气泡产生, 硼酸中没有气泡产生 | 酸性:醋酸>碳酸>硼酸 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙二醇 | B. | 乙醇 | C. | 乙醛 | D. | 丙三醇 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在外电路中,电子由负极流向正极 | |
| B. | 在内电路中,电子由正极流向负极 | |
| C. | 原电池工作时,正极表面一定有气泡产生 | |
| D. | 原电池工作时,一定不会伴随着热能变化 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com