
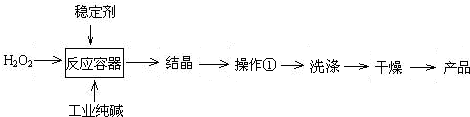
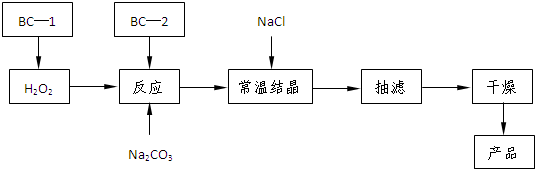
过碳酸钠(2Na2CO3·3H2O2)俗称固体双氧水,是一种很好的消毒剂和供氧剂(有活性氧存在),外观为白色自由流动颗粒,其制备流程如下图所示。图中BC—1、BC—2均为稳定剂,其中BC—1是由异丙醇和三乙醇胺按一定比例混合而成。
 |
过碳酸钠简易制备工艺路线
(1)制备过程中加入BC—1的目的是 。
(2)结晶过程中加入氯化钠、搅拌,作用是 。
(3)洗涤抽滤产品,合适的洗涤试剂是 (填选项编号)。
A.饱和NaCl溶液 B.水 C.异丙醇 D.碳酸钠饱和溶液
(4)写出制备过碳酸钠的方程式: 。
(5)由实验测定反应温度对产物的影响如下表:
| T/°C | 活性氧百分含量 | 产率 |
| 5~10 | 13.94 | 85.49 |
| 10~15 | 14.02 | 85.78 |
| 15~20 | 15.05 | 88.38 |
| 20~25 | 14.46 | 83.01 |
根据上表数据,你认为反应最佳的温度选择的范围是 。
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:阅读理解
查看答案和解析>>
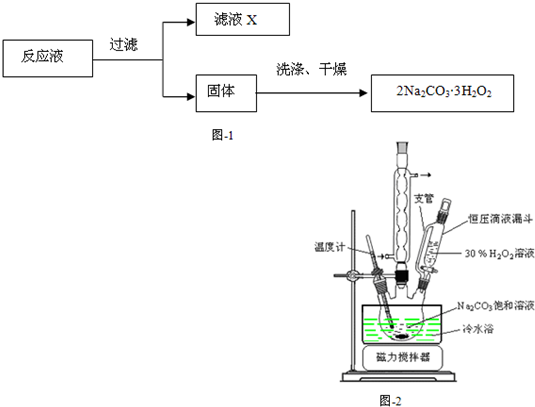
科目:高中化学 来源: 题型:
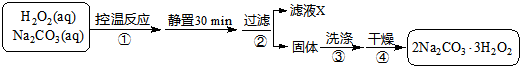
 已知:主反应 2Na2CO3 (aq)+3H2O2 (aq)
已知:主反应 2Na2CO3 (aq)+3H2O2 (aq)  2Na2CO3?3H2O2 (s)
2Na2CO3?3H2O2 (s)查看答案和解析>>
科目:高中化学 来源: 题型:
314(m1-
| ||
| 102m1 |
314(m1-
| ||
| 102m1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| T/°C | 活性氧百分含量 | 产率 |
| 5~10 | 13.94 | 85.49 |
| 10~15 | 14.02 | 85.78 |
| 15~20 | 15.05 | 88.38 |
| 20~25 | 14.46 | 83.01 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、实验室制备过碳酸钠时可釆用冷水浴控制反应温度 | B、过碳酸钠水溶液呈碱性,可用作漂洗剂和消毒杀菌剂 | C、过碳酸钠应密封保存,放置于冷暗处 | D、过碳酸钠可使酸性高锰酸钾溶液褪色,并放出一种无色气体 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com