
| A、KBr |
| B、NaOH |
| C、HBr |
| D、NH4NO3 |


 新非凡教辅冲刺100分系列答案
新非凡教辅冲刺100分系列答案科目:高中化学 来源: 题型:
| 3-n |
| 2 |
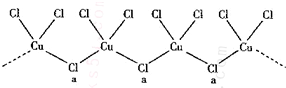
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用水湿润pH试纸测量某溶液的pH值 |
| B、盛放NaOH溶液时.使用带玻璃塞的磨口瓶 |
| C、用50 mL酸式滴定管可准确量取25.00 mLKMnO4溶液 |
| D、用苯萃取溴水中的溴时,将溴的苯溶液从分液漏斗下口放出 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、标准状况下,11.2L CC14含有的分子数目为3.01×1023 |
| B、热稳定性:Na2CO3<NaHCO3 |
| C、Na2O2和Na2CO3中阴阳离子个数比相同 |
| D、某无色溶液中加Ba(NO3)2溶液,再加入稀盐酸,产生白色沉淀,则原溶液一定含有SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、压缩盛有I2和H2混合气体的针筒,气体颜色变深 |
| B、pH均为4的盐酸和NH4Cl(aq)中水的电离度后者大 |
| C、打开汽水瓶盖,即有大量气泡逸出 |
| D、用排饱和食盐水的方法收集氯气 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| X | Y | ||
| W | Z |
| A、X、Y、Z三种元素最低价氢化物的沸点依次升高 |
| B、W、X、Y的原子半径依次减小 |
| C、W、Z的单核离子均能促进水的电离 |
| D、W的氧化物能溶解在氨水中. |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com