
| A. | 用FeCl3溶液腐蚀铜线路板:Fe3++3Cu═Fe2++3Cu2+ | |
| B. | 少量氨气中通入过量亚硫酸溶液中:NH3+H2SO3═NH4++HSO3- | |
| C. | Cl2与水反应生成盐酸和次氯酸:Cl2+H2O═H++Cl-+HClO | |
| D. | 小苏打溶液中加入过量的烧碱溶液:HCO3-+OH-═CO32-+H2O |
分析 A.电子、电荷不守恒;
B.反应生成亚硫酸氢铵;
C.反应生成盐酸和HClO;
D.反应生成碳酸钠和水.
解答 解:A.用FeCl3溶液腐蚀铜线路板的离子反应为2Fe3++Cu═2Fe2++Cu2+,故A错误;
B.少量氨气中通入过量亚硫酸溶液中的离子反应为NH3+H2SO3═NH4++HSO3-,故B正确;
C.Cl2与水反应生成盐酸和次氯酸的离子反应为Cl2+H2O═H++Cl-+HClO,故C正确;
D.小苏打溶液中加入过量的烧碱溶液的离子反应为HCO3-+OH-═CO32-+H2O,故D正确;
故选A.
点评 本题考查离子反应方程式书写的正误判断,为高频考点,把握发生的反应及离子反应的书写方法为解答的关键,侧重复分解反应、氧化还原反应的离子反应考查,注意离子反应中保留化学式的物质及电子、电荷守恒,题目难度不大.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 胶体的本质特征是胶粒直径在1nm~100nm | |
| B. | 煮沸饱和FeCl3溶液可以制得Fe(OH)3胶体 | |
| C. | 丁达尔现象可以用来区别胶体和溶液 | |
| D. | 溶液和胶体的分散质都能通过滤纸孔隙 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
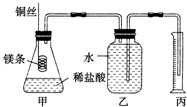 某研究性学习小组欲测定室温下(25℃、101kPa)的气体摩尔体积,请回答下列问题.该小组设计的简单实验装置如图所示:
某研究性学习小组欲测定室温下(25℃、101kPa)的气体摩尔体积,请回答下列问题.该小组设计的简单实验装置如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 亚硫酸钠 | B. | 硝酸银 | C. | 碳酸钠 | D. | 氯化铝 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com