
【题目】在一定条件下N2 + 3H2 2NH3 的反应中,起始N2浓度为2mol/L,H2浓度为5mol/L, 反应到2分钟时,测得 NH3 的反应速率为v(NH3 )=0.4mol/(L·min),填空:
(1) NH3 的转化浓度为c(NH3 )=___________ mol/(L·min)
(2)三段式填空:
(mol/L) N2 + 3H2 2NH3
起始浓度 2 5 0
转化浓度 _ _ _
2min后浓度 _ _ _
(3)用v(N2)表示的反应速率为:v(N2)=__________mol/(L·min)
(4)用v(H2)表示的反应速率为:v(H2)=__________mol/(L·min)
科目:高中化学 来源: 题型:
【题目】一种新型燃料电池,用两根金属作电极插入KOH溶液中,然后向两极分别通入甲烷和氧气,其电极反应为X极:CH4+10OH--8e-===CO32-+7H2O;Y极:4H2O+2O2+8e-===8OH-。下列关于此燃料电池的说法中,错误的是( )
A. X为负极,Y为正极
B. 工作一段时间后,KOH的物质的量减少
C. 在标准状况下,通入5.6 L O2完全反应后,有1 mol电子发生转移
D. 该电池工作时,X极附近溶液的碱性增强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A、B、D是食品中的常见有机物,A是生物的主要供能物质。以A和水煤气(CO、H2)为原料在一定条件下可获得有机物B、C、D、E、F,其相互转化关系如图。已知E是CO和H2以物质的量之比1:2反应的产物,F为具有特殊香味、不易溶于水的油状液体。
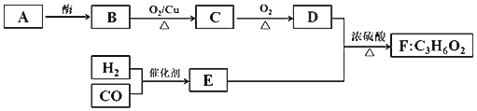
请回答:
(1)有机物D中含有的官能团名称是______。
(2)B→C化学方程式是______。
(3)下列说法不正确的是______(填字母)。
A.有机物B与金属钠反应比水与金属钠反应要剧烈
B.除去F中含有D、E杂质可用NaOH溶液洗涤、分液
C.D和E反应生成F时,浓硫酸主要起强氧化剂作用
D.C在一定条件下可以与H2反应转化为B
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实不能用化学平衡移动原理解释的是
A.新制氯水长时间放置颜色变浅
B.滴加少量硫酸铜溶液可加快Zn与稀硫酸反应的速率
C.蒸干![]() 溶液无法得到无水
溶液无法得到无水![]()
D.高压比常压更有利于合成氨
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从葡萄籽中提取的原花青素结构如图,具有生物活性,如抗氧化和自由基清除能力等。有关原花青素的下列说法不正确的是

A. 该物质可以看作醇类,也可看做酚类
B. 1 mol该物质可与4 mol Br2反应
C. 1 mol该物质可与7 mol NaOH反应
D. 1 mol该物质可与7 mol Na反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】醇脱水是合成烯烃的常用方法,实验室合成环己烯的反应和实验装置如下:
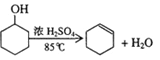
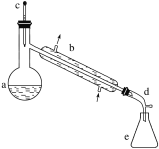
可能用到的有关数据如下:
相对分子质量 | 密度/g·cm-3 | 沸点/℃ | 溶解性 | |
环己醇 | 100 | 0.961 8 | 161 | 微溶于水 |
环己烯 | 82 | 0.810 2 | 83 | 难溶于水 |
合成反应:
在a中加入20 g环己醇和2小片碎瓷片,冷却搅动下慢慢加入1 mL浓硫酸。b中通入冷却水后,开始缓慢加热a,控制馏出物的温度不超过90 ℃。
分离提纯:
反应粗产物倒入分液漏斗中分别用少量5%碳酸钠溶液和水洗涤,分离后加入无水氯化钙颗粒,静置一段时间后弃去氯化钙。最终通过蒸馏得到纯净环己烯10 g。
回答下列问题:
(1)装置b的名称是________。
(2)加入碎瓷片的作用是_____________________________________________________;
如果加热一段时间后发现忘记加瓷片,应该采取的正确操作是________(填字母,下同)。
A.立即补加 B.冷却后补加 C.不需补加 D.重新配料
(3)本实验中最容易产生的副产物的结构简式为____________________________________。
(4)分液漏斗在使用前须清洗干净并_____;在本实验分离过程中,产物应该从分液漏斗的_____(填“上口倒出”或“下口放出”)。
(5)分离提纯过程中加入无水氯化钙的目的是______________________________。
(6)在环己烯粗产物蒸馏过程中,不可能用到的仪器有________。
A.接收器 B.温度计 C.吸滤瓶 D.球形冷凝管
(7)本实验所得到的环己烯产率是________。
A.41% B.50% C.61% D.70%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】松油醇是一种调香香精,它是α、β、γ三种同分异构体组成的混合物,可由松节油分馏产品A(下式中的18是为区分两个羟基而人为加上去的)经下列反应制得:

(1)A分子中的官能团名称是_________________。
(2)A分子能发生的反应类型是________。
a.加成 b.取代 c.催化氧化 d.消去
(3)α-松油醇的分子式_________________。
(4)α-松油醇所属的有机物类别是________。
a.酸 b.醛 c.烯烃 d.不饱和醇
(5)写结构简式:β-松油醇_____________,γ-松油醇_____________。
(6)写出α-松油醇与乙酸发生酯化反应的方程:___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示三个烧瓶中分别装入含酚酞的0.01 mol·L-1 CH3COONa溶液,并分别放置在盛有水的烧杯中,然后向烧杯①中加入生石灰;向烧杯③中加入NH4NO3晶体;烧杯②中不加任何物质。

(1)含酚酞的0.01 mol·L-1 CH3COONa溶液显浅红色的原因为________(请写出相应的离子方程式和必要的文字说明)。
(2)实验过程中发现烧瓶①中溶液红色变深,烧瓶③中溶液红色变浅,则下列叙述正确的是_____。
A.水解反应为放热反应 B.水解反应为吸热反应
C.NH4NO3溶于水时放出热量 D.NH4NO3溶于水时吸收热量
(3)向0.01 mol·L-1 CH3COONa溶液中分别加入少量浓盐酸、NaOH固体、Na2CO3固体、FeSO4固体,使CH3COO-水解平衡移动的方向分别为____、___、____、____(填“左”“右”或“不移动”)。
(4)已知室温时,CH3COOH电离常数为1.75×10-5,NH3·H2O电离常数为1.75×10-5。浓度均为0.1 mol·L-1的下列溶液:①CH3COONa、②NH4Cl、③CH3COONH4、④(NH4)2SO4,pH由小到大排列的正确顺序为 ____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物I(分子式为C19H20O4)属于芳香酯类物质,是一种调香剂,其合成路线如下:

已知:①A属于脂肪烃,核磁共振氢谱显示有2组峰,面积比为3:1,其蒸气密度是相同条件下H2的28倍;D分子式为C4H8O3;E分子式为C4H6O2,能使溴水褪色。
② 其中R为烃基。
其中R为烃基。
③ 其中R1和R2均为烃基。
其中R1和R2均为烃基。
回答下列问题:
(1)A的结构简式为___________________。
(2)D中官能团的名称是______________________。
(3)反应②的化学方程式为______________。
(4)E的同系物K比E多一个碳原子,K有多种链状同分异构体,其中能发生银镜反应且能水解的有_______种。
(5)反应①~⑦属于取代反应的是__________(填序号)。
(6)反应⑦的化学方程式为_________________。
(7)参照上述合成路线,以  为原料(无机试剂任选),经4步反应制备可降解塑料
为原料(无机试剂任选),经4步反应制备可降解塑料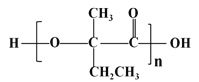 _____________。
_____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com