
右图为持续电解含一定CaCl2的溶液的装置(以铂为电极),A为电流表。电解一段时间t1后,将CO2连续通入电解液中。
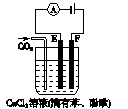
(1)电解时,F极发生 反应,电极反应式为 ,E极发生 反应,电极反应式为 ,电解总反应式为 。
(2)电解池中产生的现象:
① ;
② ;
③ 。
科目:高中化学 来源: 题型:022
下图为持续电解含一定CaCl2水溶液的装置(以铂为电极),A为电流表。电解一段时间t1后,将CO2连续通入到电解液中。
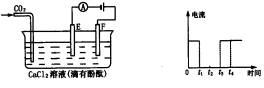
(1)请在右图中完成左图实验中电流对时间的变化关系图。
(2)电解时,F极的电极反应式为________,
电解总反应式为________________。
(3)电解池中产生的现象:
①__________________________________
②__________________________________
③__________________________________
查看答案和解析>>
科目:高中化学 来源:物理教研室 题型:022

(1)请在右图中完成左图实验中电流对时间的变化关系图。
(2)电解时,F极的电极反应式为________,
电解总反应式为________________。
(3)电解池中产生的现象:
①__________________________________
②__________________________________
③__________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
 盐城作为沿海地区有着丰富的海水资源,海水中主要含有Na+、K+、Ca2+、Mg2+、Cl-、SO42-、Br-、CO32-、HCO3-等离子。合理利用资源和保护环境是我市可持续发展的重要保证。
盐城作为沿海地区有着丰富的海水资源,海水中主要含有Na+、K+、Ca2+、Mg2+、Cl-、SO42-、Br-、CO32-、HCO3-等离子。合理利用资源和保护环境是我市可持续发展的重要保证。
![]() (1)海水经过处理后可以得到无水氯化镁,无水氯化镁是工业制取镁的原料。试写出电解熔融氯化镁制取金属镁的化学反应方程式 。
(1)海水经过处理后可以得到无水氯化镁,无水氯化镁是工业制取镁的原料。试写出电解熔融氯化镁制取金属镁的化学反应方程式 。
(2)某化工厂生产过程中会产生含有Cu2+和Pb2+的污水。排放前拟用沉淀法除去这两种离子,根据下列数据,你认为投入 (选填“Na2S”或“NaOH”)效果更好。
| 难溶电解质 | Cu(OH)2 | CuS | Pb(OH)2 | PbS |
| Ksp | 4.8×10-20 | 6.3×10-36 | 1.2×10-15 | 1.0×10-28 |
 |
 ①天然海水的pH≈8,试用离子方程式解释天然海水呈弱碱性的原因 (任写一个)。
①天然海水的pH≈8,试用离子方程式解释天然海水呈弱碱性的原因 (任写一个)。
②某研究小组为探究提高含硫烟气中SO2吸收效率的措施,进行了天然海水吸收含硫烟气的模拟实验,实验结果如右图所示。
请你根据图示实验结果,就如何提高一定浓度含硫烟气中SO2的吸收效率,提出一条合理化建议: 。
③天然海水吸收了含硫烟气后会溶有H2SO3、HSO3-等分子或离子,使用氧气将其氧化的化学原理是 (任写一个化学方程式或离子方程式)。氧化后的“海水”需要引入大量的天然海水与之混合后才能排放,该操作的主要目的是 。
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
盐城作为沿海地区有着丰富的海水资源,海水中主要含有Na+、K+、Ca2+、Mg2+、Cl-、SO42-、Br-、CO32-、HCO3-等离子。合理利用资源和保护环境是我市可持续发展的重要保证。
![]() (1)海水经过处理后可以得到无水氯化镁,无水氯化镁是工业制取镁的原料。试写出电解熔融氯化镁制取金属镁的化学反应方程式 。
(1)海水经过处理后可以得到无水氯化镁,无水氯化镁是工业制取镁的原料。试写出电解熔融氯化镁制取金属镁的化学反应方程式 。
(2)某化工厂生产过程中会产生含有Cu2+和Pb2+的污水。排放前拟用沉淀法除去这两种离子,根据下列数据,你认为投入 (选填“Na2S”或“NaOH”)效果更好。
| 难溶电解质 | Cu(OH)2 | CuS | Pb(OH)2 | PbS |
| Ksp | 4.8×10-20 | 6.3×10-36 | 1.2×10-15 | 1.0×10-28 |
 |
 ①天然海水的pH≈8,试用离子方程式解释天然海水呈弱碱性的原因 (任写一个)。
①天然海水的pH≈8,试用离子方程式解释天然海水呈弱碱性的原因 (任写一个)。
②某研究小组为探究提高含硫烟气中SO2吸收效率的措施,进行了天然海水吸收含硫烟气的模拟实验,实验结果如右图所示。
请你根据图示实验结果,就如何提高一定浓度含硫烟气中SO2的吸收效率,提出一条合理化建议: 。
 ③天然海水吸收了含硫烟气后会溶有H2SO3、HSO3-等分子或离子,使用氧气将其氧化的化学原理是 (任写一个化学方程式或离子方程式)。氧化后的“海水”需要引入大量的天然海水与之混合后才能排放,该操作的主要目的是 。
③天然海水吸收了含硫烟气后会溶有H2SO3、HSO3-等分子或离子,使用氧气将其氧化的化学原理是 (任写一个化学方程式或离子方程式)。氧化后的“海水”需要引入大量的天然海水与之混合后才能排放,该操作的主要目的是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com