
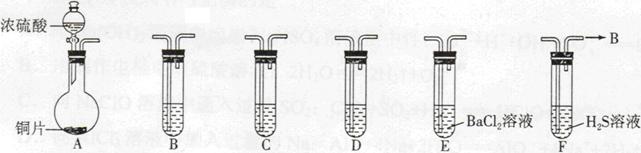
 CuSO4+SO2↑+2H2O; 1分
CuSO4+SO2↑+2H2O; 1分
|
 CuSO4+SO2↑+2H2O;烧瓶中的实验现象为铜片变灰黑色表面有气泡生成,烧瓶中可能有白色物质生成
CuSO4+SO2↑+2H2O;烧瓶中的实验现象为铜片变灰黑色表面有气泡生成,烧瓶中可能有白色物质生成

 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:不详 题型:单选题
| A.单质硅是将太阳能转化为电能的常用材料 |
| B.硅酸钠的俗名为玻璃,可用于制备硅胶和木材防火剂 |
| C.用浓H2SO4刻蚀工艺玻璃上的纹饰 |
| D.SO2具有氧化性,可用来漂白纸浆 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.SO2和SO3都是酸性氧化物,二者的水溶液都是强酸 |
| B.将铜片放入浓硫酸中,无明显现象是因为铜片发生了钝化 |
| C.硫粉在过量的纯氧中燃烧可以生成大量的SO3 |
| D.富含硫黄的矿物在工业上可用于制造硫酸 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
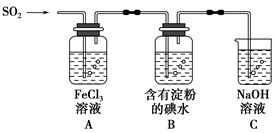
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 2SO3(g);△H<0,将SO2转化为SO3,尾气SO2可用NaOH溶液进行吸收。请回答下列问题:
2SO3(g);△H<0,将SO2转化为SO3,尾气SO2可用NaOH溶液进行吸收。请回答下列问题:| 实验编号 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
| SO2 | O2 | SO2 | O2 | |||
| 1 | T1 | 4 | 2 | x | 0.8 | 6 |
| 2 | T2 | 4 | 2 | 0.4 | y | 9 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
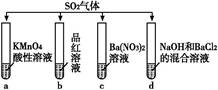
| A.试管a中实验可以证明SO2具有漂白性 |
| B.试管b中溶液褪色,说明SO2具有强氧化性 |
| C.试管c中能产生白色沉淀,说明SO2具有还原性 |
| D.试管d中能产生白色沉淀,该沉淀完全溶于稀硝酸 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
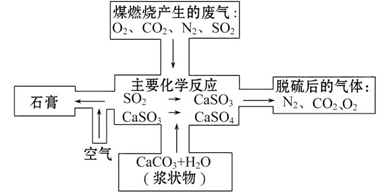
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.BaSO4 | B.BaSO3 | C.BaS | D.BaSO4和BaSO3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com