
| A. | 苯与溴能发生取代反应,因此不能用苯萃取溴水中的溴 | |
| B. | 相同质量的苯和立方烷(C${\;}_{{8}_{\;}}$H8)完全燃烧,耗氧量一样多 | |
| C. | 乙烯和聚乙烯都能发生加成反应 | |
| D. | 为了防止蛋白质盐析,疫苗等生物制剂应冷冻储存 |
科目:高中化学 来源: 题型:选择题
| A. | 在Na2CO3、NaHCO3两溶液中,离子种类不相同 | |
| B. | 在NaHCO3溶液中有c(H+)+c(Na+)=c(OH-)+c(CO32-)+c(HCO3-) | |
| C. | 在Na2CO3溶液中有c(OH-)=c(H+)+c(HCO3-)+2 c(H2CO3) | |
| D. | 在Na2CO3溶液中有2c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 漂白粉密封保存,因为潮湿条件下易于CO2反应 | |
| B. | 光导纤维是将太阳能直接转化为电能的常见材料 | |
| C. | 用氢氟酸蚀刻玻璃和用FeCl3溶液蚀刻铜值线路板,均属于氧化还原反应 | |
| D. | 家用消毒柜中通过高压放电使空气产生少量臭氧,这一过程属于物理变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
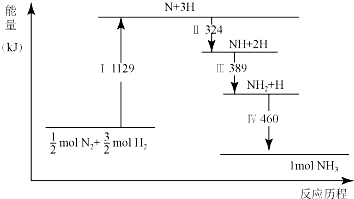
| A. | Ⅰ中破坏的均为极性键 | B. | Ⅳ中NH2与H2生成NH3 | ||
| C. | Ⅱ、Ⅲ、Ⅳ均为放热过程 | D. | N2(g)+3H2(g)?2NH3(g)△H>0 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
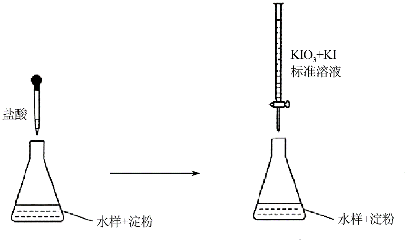
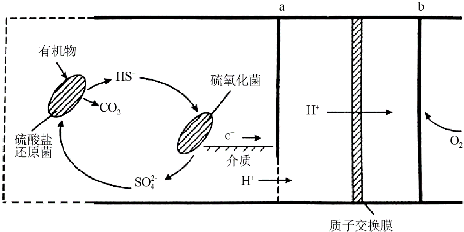
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
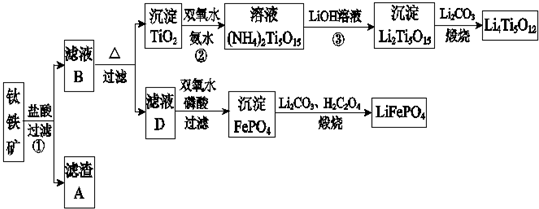
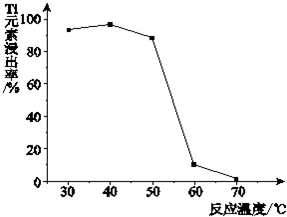
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2KBr+Cl2=2KCl+Br2 | B. | CaCO3=CaO+CO2↑ | ||
| C. | SO3+H2O=H2SO4 | D. | MgCl2+2NaOH=Mg(OH)2↓+NaCl |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
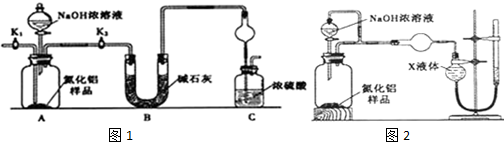
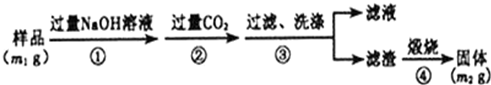
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com