
已知X、Y、Z元素的原子具有相同的电子层数,且原子序数依次增大,其最高价氧化物对应水化物酸性依次增强,下列判断正确的是
A.最高化合价按X、Y、Z的顺序减小
B.阴离子的还原性按X、Y、Z顺序增强
C.单质的氧化性按X、Y、Z顺序增强
D.氢化物的稳定性按X、Y、Z顺序减小
科目:高中化学 来源:2014-2015浙江省台州市高一下学期第一次月考化学试卷(解析版) 题型:选择题
下列性质中,可以证明某化合物一定存在离子键的是
A.可溶于水 B.具有较高的熔点
C.水溶液能导电 D.熔融状态能导电
查看答案和解析>>
科目:高中化学 来源:2014-2015学年湖北武汉市高三毕业生四月调研测试理综化学试卷(解析版) 题型:实验题
(14分)世界环保联盟建议全面禁止使用氯气用于饮用水的消毒,而建议采用高效“绿色”消毒剂二氧化氯。二氧化氯是一种极易爆炸的强氧化性气体,易溶于水、不稳定、呈黄绿色,在生产和使用时必须尽量用稀有气体进行稀释,同时需要避免光照、震动或加热。实验室以电解法制备ClO2的流程如下:
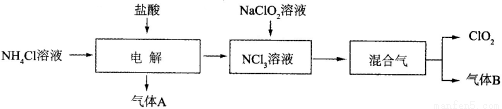
已知:①NCl3是黄色黏稠状液体或斜方形晶体,极易爆炸,有类似氯气的刺激性气味,自然爆炸点为95℃,在热水中易分解,在空气中易挥发,不稳定。②气体B能使湿润的红色石蕊试纸变蓝。
回答下列问题:
(1)电解时,发生反应的化学方程式为_____________________________________。实验室制备气体B的化学方程式为____________________________。为保证实验的安全,在电解时需注意的问题是:①控制好生成NCl3的浓度;②_______________________。
(2)NCl3与NaClO2(亚氯酸钠)按物质的量之比为1∶6混合,在溶液中恰好反应生成ClO2,该反应的离子方程式为_________________________________________ 。
(3)ClO2很不稳定,需随用随制,产物用水吸收得到ClO2溶液。为测定所得溶液中ClO2的含量,进行了下列实验:
步骤1:准确量取ClO2溶液10 mL,稀释成100 mL试样;
步骤2:量取V1 mL试样加入到锥形瓶中,调节试样的pH≤2.0,加入足量的KI晶体,摇匀,在暗处静置30 min
步骤3:以淀粉溶液作指示剂,用c mol/L Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液V2 mL。(已知I2+2S2O32-=2I-+S4O62-)
①上述步骤3中滴定终点的现象是_______________________________;
②根据上述步骤可计算出原ClO2溶液的浓度为___________g/L(用含字母的代数式表示)。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年河南省八市高三教学质量监测考试理科综合化学试卷(解析版) 题型:选择题
X、Y、Z、W是原子序数依次增大的四种短周期主族元素,已知Z的最高正价与最低负价的代数和为4,Y能形成两种常见的液体二元化合物M、Q,其中M是生物生存必需的物质.x能形成多种单质,其中有两种单质硬度差异极大,下列说法中错误的是
A.最高价氧化物对应水化物的酸性:w>Z>x
B.化合物Q中存在两种类型的共价键
C.Z、X都可以形成两种常见的酸性氧化物
D.四种元素的常见单质中X的单质的沸点最高
查看答案和解析>>
科目:高中化学 来源:2014-2015学年广东省惠州市高三4月模拟考试理综化学试卷(解析版) 题型:填空题
(16分)一定条件下,在一容积为4 L的密闭容器中通入0.4 molN2和1.2 molH2,发生反应:N2(g)+3H2(g) 2NH3(g) △H<0;
2NH3(g) △H<0;
(1)当进行到第4分钟时达到平衡,生成NH3为0.4 mol,则从开始到达平衡时NH3的平均速率v(NH3)=_____________(注明单位)。
(2)该条件下,反应的平衡常数表达式K = ______ ,若降低温度,K值将_____(填“增大”“减小”“不变”)
(3)达到平衡后,若其它条件不变,把容器体积缩小一半,平衡将_____移动(“向逆反应方向”、“向正反应方向”或“不”).
(4)在三个相同的容器中各充入1 molN2和3molH2,在不同条件下分别达到平衡,氨的体积分数随时间变化如图。下列说法正确的是 。
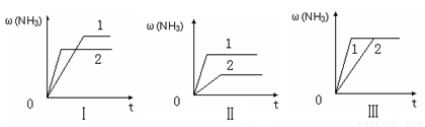
a.图Ⅰ可能是不同压强对反应的影响,且P2>P1
b.图Ⅱ可能是不同温度对反应的影响,且T1>T2
c.图Ⅲ可能是同温同压下,催化剂性能,1>2
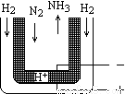
(5)常压下,把H2和用氦气(He)稀释的N2分别通入一个加热到570℃的电解池装置,H2和N2便可在电极上合成氨,装置中所用的电解质(图中黑细点)能传导H+,则阴极的电极反应式为____________________。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年广东茂名市高三第二次高考模拟考试理综化学试卷(解析版) 题型:填空题
(17分)KMnO4是常见的试剂。
Ⅰ.某小组拟用酸性KMnO4溶液与H2C2O4(K1=5.4×10-2)的反应(此反应为放热反应)来探究“条件对化学反应速率的影响”,并设计了如下的方案记录实验结果(忽略溶液混合体积变化)。限选试剂和仪器:0.20 mol/L H2C2O4溶液、0.010mol/L KMnO4溶液(酸性)、蒸馏水、试管、量筒、秒表、恒温水浴槽
物理量 编号 | V(0.20 mol/L H2C2O4溶液)/mL | 甲 | V(0.010mol/L KMnO4溶液)/mL | M(MnSO4固体)/g | T/℃ | 乙 |
① | 2.0 | 0 | 4.0 | 0 | 50 | |
② | 2.0 | 0 | 4.0 | 0 | 25 | |
③ | 1.0 | a | 4.0 | 0 | 25 | |
④ | 2.0 | 0 | 4.0 | 0.1 | 25 |
回答下列问题:
(1)完成上述反应原理的离子反应方程式
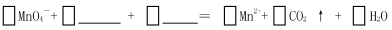
(2)上述实验①②是探究 对化学反应速率的影响;若上述实验②③是探究浓度对化学反应速率的影响,则表格中“甲”应填写 ,a为 ;乙是实验需要测量的物理量,则表格中“乙”应填写 。
(3)上述实验②④是探究催化剂对化学反应速率的影响。
请在答题卷的坐标图中画出实验②和④的能量变化关系图(作必要的标注)。
Ⅱ.某化学小组利用下图装置进行实验证明氧化性:KMnO4>Cl2>Br2。限选试剂:KBr溶液、KMnO4、浓盐酸、浓硫酸
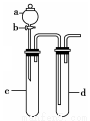
(4)装置a、d中盛放的试剂分别是: 、 ;实验中观察到的现象为 ;此实验装置的不足之处是 。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年广东茂名市高三第二次高考模拟考试理综化学试卷(解析版) 题型:选择题
短周期主族元素X、Y、Z、W在元素周期表中的相对位置如下图所示。已知X的最低负价与Y的最高正价代数和为零,下列说法正确的是
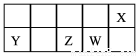
A.X分别与Y、Z形成的化合物中化学键类型相同
B.Z的最高价氧化物的对应水化物酸性比W的强
C.X的简单气态氢化物的稳定性比W的弱
D.原子半径的大小顺序:r(Y)>r(Z)>r(W)>r(X)
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江苏省南京市、盐城市高三第二次模拟考试化学试卷(解析版) 题型:选择题
一种三室微生物燃料电池污水净化系统原理如右图所示,图中有机废水中有机物可用C6H10O5表示。下列有关说法正确的是
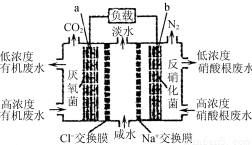
A.b电极为该电池的负极
B.b电极附近溶液的pH减小
C.a电极反应式:C6H10O5-24e-+7H2O===6CO2↑+24H+
D.中间室:Na+移向左室,Cl-移向右室
查看答案和解析>>
科目:高中化学 来源:2014-2015学年湖南省常德市高三模拟考试理综化学试卷(解析版) 题型:选择题
下列说法正确的是
A.NaHSO4溶液中,c(Na+) +c(H+) = c(SO42-) + c(OH-)
B.室温时水电离出来的c(H+)=10-13mol/L的溶液中K+、Cl-、NO3-、I-一定能大量共存
C.等物质的量浓度的下列溶液:①H2CO3 ②Na2CO3 ③NaHCO3 ④(NH4)2CO3中c(CO32-)的大小关系为:②>④>③>①
D.在明矾溶液中加入氢氧化钡溶液至沉淀的质量达到最大值时发生反应的离子方程式:2Al3++3SO42-+3Ba2++6OH-=3BaSO4↓+2Al(OH)3↓
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com