
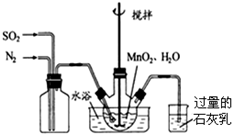
分析 (1)①根据实验装置图可知,左边集气瓶的作用是混合SO2和N2;
②石灰乳的作用是吸收尾气二氧化硫,碱和酸性氧化物反应得到对应的盐和水;
③MnO2做氧化剂把亚硫酸氧化为硫酸,自身被还原为Mn2+,据此书写反应的离子方程式;
④为使SO2尽可能转化完全,一定要保证控制反应的温度,在通入SO2和N2比例一定、不改变固液投料的条件下,要求所通气体一定要慢;
(2)制取的原理是碳酸根和锰离子之间反应生成碳酸锰的过程,但要考虑MnCO3难溶于水、乙醇并在潮湿时易被空气氧化,100℃开始分解以及Mn(OH)2开始沉淀时pH=7.7等因素,过程中控制溶液的PH值以及洗涤沉淀所选的溶剂要小心,据此答题.
解答 解:(1)①左边集气瓶可以使通入的SO2和N2混合均匀,故答案为:混合SO2和N2;
②石灰乳的作用是吸收尾气二氧化硫,碱和酸性氧化物反应得到对应的盐和水,反应的化学方程式为:SO2+Ca(OH)2=CaSO3+H2O,
故答案为:SO2+Ca(OH)2=CaSO3+H2O;
③MnO2做氧化剂把亚硫酸氧化为硫酸,自身被还原为Mn2+,反应的离子方程式为:MnO2+H2SO3=Mn2++SO42-+H2O,
故答案为:MnO2+H2SO3=Mn2++SO42-+H2O;
④使SO2尽可能转化完全,应定要保证控制反应的温度,在通入SO2和N2比例一定、不改变固液投料的条件下,要求所通气体一定要慢,
故答案为:ac;
(2)②已知MnCO3难溶于水,所以加入碳酸钠后反应生成碳酸锰,过滤,水洗2~3次,
故答案为:过滤,水洗2~3次;
③检验硫酸根离子是否洗净,可以检验最后一次洗涤液是否含有硫酸根离子,操作方法为:取最后一次洗涤的滤液少量于试管,加入用盐酸酸化的BaCl2溶液,若无明显现象,说明水洗合格,
故答案为:取最后一次洗涤的滤液少量于试管,加入用盐酸酸化的BaCl2溶液,若无明显现象,说明水洗合格;
④已知MnCO3难溶于水、乙醇,潮湿时易被空气氧化,乙醇容易挥发,便于低温干燥,防止MnCO3 受潮被氧化,受热分解,
故答案为:乙醇容易挥发,便于低温干燥,防止MnCO3 受潮被氧化,受热分解.
点评 本题主要考查了制备高纯碳酸锰实验方案,题目难度中等,明确工艺流程、正确识图、理解离子反应的本质是解答的关键,试题的综合性强,充分考查了学生的分析能力及化学实验能力.


科目:高中化学 来源: 题型:解答题
 常温下,将某一元酸HA和NaOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如表:
常温下,将某一元酸HA和NaOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如表:| 实验编号 | HA物质的量浓度 (mol•L-1) | NaOH物质的量浓度 (mol•L-1) | 混合溶液的pH |
| ① | 0.1 | 0.1 | pH=9 |
| ② | c | 0.2 | pH=7 |
| ③ | 0.2 | 0.1 | pH<7 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
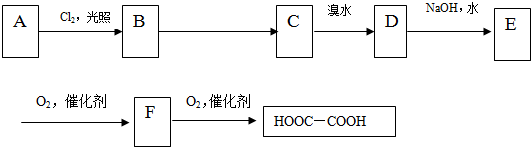
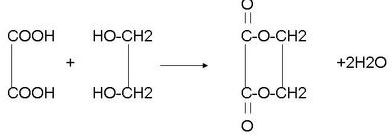 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2CO3是强电解质,BaCO3是弱电解质 | |
| B. | c(H+)=1×10-7mol•L-1的溶液一定呈中性 | |
| C. | 将硫酸铝和氯化铝溶液分别加热蒸干后灼烧,得到的固体都是氧化铝 | |
| D. | 将0.1 mol•L-1醋酸溶液加水稀释时,电离能力增强,但c(H+)变小 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| 时间/min | 0 | 10 | 20 | 40 | 50 | |
| T1 | n(CH4)/mol | 0.50 | 0.35 | 0.25 | 0.10 | 0.10 |
| T2 | n(CH4)/mol | 0.50 | 0.30 | 0.18 | … | 0.15 |
| A. | T2时CH4的平衡转化率为70.0% | |
| B. | 该反应的△H>0、T1<T2 | |
| C. | 保持其他条件不变,T1时向平衡体系中再充入0.30 mol CH4和0.80 mol H2O(g),平衡向正反应方向移动 | |
| D. | 保持其他条件不变,T1时向平衡体系中再充入0.50 mol CH4和1.20 mol NO2,与原平衡相比,达新平衡时N2的浓度增大、体积分数减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
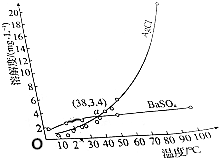
| A. | a点时,AgCl和BaSO4饱和溶液的密度基本相同 | |
| B. | AgCl的溶解是吸热过程 | |
| C. | 室温时,向等体积的饱和AgCl和BaSO4溶液中分别加入足量的浓BaCl2溶液,析出BaSO4沉淀的质量比AgCl多 | |
| D. | 可以用重结晶的方法分离AgCl和BaSO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,含有离子键和非极性共价键的化合物的电子式为
,含有离子键和非极性共价键的化合物的电子式为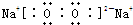 ;含有极性共价键和非极性共价键的化合物的电子式为
;含有极性共价键和非极性共价键的化合物的电子式为 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 晶体中不存在独立的“分子” | |
| B. | 含有1 mol C的金刚石中,形成的共价键有2 mol | |
| C. | 是自然界中硬度最大的物质 | |
| D. | 化学性质稳定,即使在高温下也不会与氧气发生反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用浓硝酸做试剂比较铁和铜的金属活动性 | |
| B. | 使用干燥洁净玻璃棒将氯水滴在干燥pH试纸上,测定氯水的pH | |
| C. | 欲检验Br-的存在,可在溶液中先加入氯水、再加入CCl4,振荡、静置,观察下层溶液显橙红色 | |
| D. | 氢氧化铁胶体在直流电场中,一段时间阴极附近红褐色加深,说明胶体带正电荷 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com