
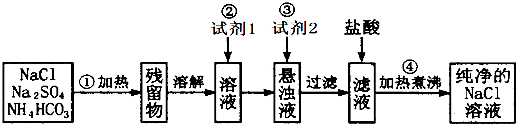
| 1000g×10g |
| 40g |
| 250g |
| 58.5g/mol |
| 1000g×10g |
| 40g |
| 250g |
| 58.5g/mol |


科目:高中化学 来源: 题型:
| ||
| A、△H2>△H3 |
| B、△H1<△H3 |
| C、△H1+△H3=△H2 |
| D、△H1+△H2>△H3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、乙醇稀溶液:K+、Na+、SO42-、OH- | ||
| B、氨水溶液:Mg2+、Ag+、NO3-、CH3COOH | ||
C、
| ||
| D、使石蕊变红的溶液:Fe2+、Al3+、ClO-、CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、第二周期元素氢化物稳定性的顺序是:HF>H2O,所以第三周期元素氢化物稳定性的顺序也是:HCl>H2S |
| B、IVA族元素氢化物熔点顺序是:SiH4>CH4,所以VA族元素氢化物熔点顺序也是:PH3>NH3 |
| C、ⅦA族元素的非金属性是:F>Cl,所以ⅦA族元素氢化物的酸性也是:HF>HCl |
| D、镁比铝活泼,工业上用电解熔融氧化铝制备铝,所以工业上也用电解熔融氧化镁制备镁 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
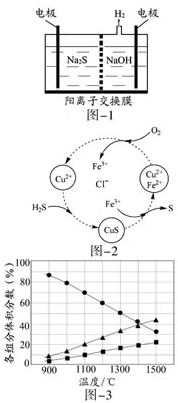 硫化氢的转化是资源利用和环境保护的重要研究课题,由硫化氢获得硫单质有多种方法.
硫化氢的转化是资源利用和环境保护的重要研究课题,由硫化氢获得硫单质有多种方法.查看答案和解析>>
科目:高中化学 来源: 题型:
| 熔点/℃ | 沸点/℃ | |
| 1-丁醇 | -89.53 | 117.25 |
| 1-溴丁烷 | -112.4 | 101.6 |
| 丁 醚 | -95.3 | 142.4 |
| 1-丁烯 | -185.5 | -6.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:
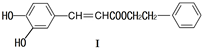

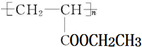 可用于制备涂料,其单体结构简式为
可用于制备涂料,其单体结构简式为查看答案和解析>>
科目:高中化学 来源: 题型:
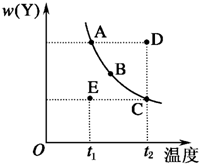 对于2X(g)?Y(g)的反应体系,在压强一定时,平衡体系中Y的质量分数w(Y)随温度的变化情况如图所示(实线上的任何一点为对应温度下的平衡状态).
对于2X(g)?Y(g)的反应体系,在压强一定时,平衡体系中Y的质量分数w(Y)随温度的变化情况如图所示(实线上的任何一点为对应温度下的平衡状态).查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com