
| A. | 2,4,4-三甲基戊烷 | B. | 4-甲基-2-戊烯 | ||
| C. | 4-甲基-5-乙基庚烷 | D. | 1,2,4-三甲基丁烷 |
分析 A、对主链进行编号时,要先从“近”,再从“多”,后从“简”;
B、含有官能团的有机物命名时,要选含官能团的最长碳链作为主链,官能团的位次最小;
C、对主链进行编号时,要从离支链近的一端开始编号;
D、选主链时,要选最长的碳链为主链.
解答 解:A、2,4,4-三甲基戊烷,该命名不满足取代基编号之和最小,说明编号方向错误,该有机物正确命名为:2,2,4-三甲基戊烷,故A错误;
B、4-甲基-2-戊烯,该命名满足离双键位置最近一端编号,故B正确;
C、庚烷中出现异丙基,说明支链不满足“由简到繁”的原则,故正确命名为:2,2,5-三甲基-3-乙基庚烷,故C错误;
D、1号碳上不能含有甲基,4号碳上不能含有甲基,故此命名说明不是选择的最长碳链,正确命名为:3-甲基己烷,故D错误,
故选B.
点评 本题考查了有机物的命名,题目难度不大,该题注重了基础性知识的考查,侧重对学生基础知识的检验和训练.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
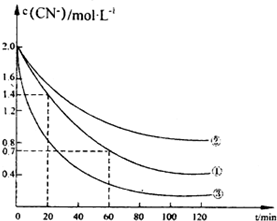 氰化物有剧毒,氰化电镀会产生大量含氰化物的废水,该电镀含氰废水中的氰化物主要是以CN一和[Fe(CN)6]3-两种形式存在.研究表明可采用双氧水氧化法处理电镀含氰废水.某化学兴趣小组模拟双氧水氧化法探究有关因素对该破氰反应速率的影晌(破氰反应是指氧化剂将CN-氧化的反应).
氰化物有剧毒,氰化电镀会产生大量含氰化物的废水,该电镀含氰废水中的氰化物主要是以CN一和[Fe(CN)6]3-两种形式存在.研究表明可采用双氧水氧化法处理电镀含氰废水.某化学兴趣小组模拟双氧水氧化法探究有关因素对该破氰反应速率的影晌(破氰反应是指氧化剂将CN-氧化的反应).| 实验序号 | 实验目的 | 初始pH | 废水样品体积mL | CuSO4溶液的体积/mL | 双氧水溶液的体积/mL | 蒸馏水的体积/mL |
| ① | 为以下实验操作参考废水的初始pH对 | 7 | 60 | 10 | 10 | 20 |
| ② | 废水的初始pH对破氯反应速率的影响 | 12 | 60 | 10 | 10 | 20 |
| ③ | 10 |
| 实验步骤(不要写出具体操作过程) | 预期实验现象和结论 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 35.5:108 | B. | 1:8 | C. | 108:35.5 | D. | 137:71 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④ | B. | ②④ | C. | ①③ | D. | ②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH4HCO3和盐酸的反应是放热反应 | |
| B. | 该反应中,热能转化为化学能 | |
| C. | 反应物的总能量高于生成物的总能量 | |
| D. | 反应的热化学方程式为:NH4HCO3+HCl=NH4Cl+CO2↑+H2O△H>0 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | m=2,n=4 | B. | m=0.5,n=4 | C. | m=2,n=0.25 | D. | m=0.5,n=0.25 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com