
| 温度(℃) | 15.0 | 20.0 | 25.0 | 30.0 | 35.0 |
| 平衡总压强(kPa) | 5.7 | 8.3 | 12.0 | 17.1 | 24.0 |
| 平衡气体总浓度 (×10-3mol/L) | 2.4 | 3.4 | 4.8 | 6.8 | 9.4 |

分析 (1)①根据达到平衡状态的特征:各组分浓度不再变化,正逆反应速率相等进行判断;
②根据化学平衡常数的表达式进行计算;
③温度越高平衡气体总浓度越大,所以正反应是吸热反应,△H大于0,△S是物质的混乱程度的,氨基甲酸铵分解反应固体变成气体;
(2)化学反应速率V=$\frac{△C}{△t}$=$\frac{2.2mol/L-1.9mol/L}{6min}$=0.05mol/(L•min).
解答 解:(1)①A、没有标明正逆反应速率,无法判断平衡状态,故A错误;
B、由于反应前后气体的化学计量数之和不相等,压强不变,达到了平衡状态,故B正确;
C、由于反应物是固体,没有达到平衡状态,气体质量会变化,容器体积不变,密度也会发生变化,所以密度不变,达到了平衡状态,故C正确;
D、氨气体积分数不变,不能说明正逆反应速率相等,各组分浓度不变,故D错误;
故选BC;
②根据反应:NH2COONH4(s)?2NH3(g)+CO2(g),n(NH3)=2n(CO2),所以K=c(CO2)=$\frac{1}{3}$×4.8×10-3mol•L-1=1.6×10-3mol•L-1,c(NH3)=$\frac{2}{3}$×4.8×10-3mol•L-1=3.2×10-3mol•L-1,依据平衡常数的表达式,25.0℃时氨基甲酸铵的分解平衡常数为:1.6×10-3mol•L-1×(3.2×10-3mol•L-1)2≈1.6×10-8(mol•L-1)3,
故答案为:K=1.6×10-8(mol•L-1)3;
③温度越高平衡气体总浓度越大,所以正反应是吸热反应,△H大于0;氨基甲酸铵分解反应是固体变成气体,混乱程度变大,△S>0,故答案为:>;>;
(2)化学反应速率V=$\frac{△C}{△t}$=$\frac{2.2mol/L-1.9mol/L}{6min}$=0.05mol/(L•min),故答案为:0.05mol/(L•min).
点评 本题考查了化学平衡状态的判断、平衡常数的计算,反应速率的计算等,注重了基础知识的考查,本题难度较大.


科目:高中化学 来源: 题型:选择题
| X | Y | Z | 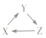 | |
| A | Si | SiO2 | Na2SiO3 | |
| B | HNO3 | NO | NO2 | |
| C | Fe | FeCl3 | Fe(OH)3 | |
| D | Na2O | NaOH | NaCl |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 混合溶液pH>7 | |
| B. | 对混合溶液进行微热,K1增大、K2减小 | |
| C. | 调节混合溶液的pH至中性,则此时溶液中c(Na+)=c(CH3COO-) | |
| D. | 温度不变,若在混合溶液中加入少量NaOH固体,c(CH3COO-)减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
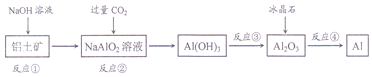
| A. | 流程中涉及的反应均为非氧化还原反应 | |
| B. | 反应②产生的阴离子主要为CO32- | |
| C. | 反应③在实验室中应在蒸发皿中进行 | |
| D. | 反应④的条件是对熔融状态下的反应物进行电解 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com