
 某学习小组用如图所示装置A、B分别探究金属锌与稀硫酸的反应,实验过程中A烧杯内的溶液温度升高,B烧杯的电流计指针发生偏转,请回答以下问题.
某学习小组用如图所示装置A、B分别探究金属锌与稀硫酸的反应,实验过程中A烧杯内的溶液温度升高,B烧杯的电流计指针发生偏转,请回答以下问题.分析 (1)锌与氢离子反应生成锌离子与氢气;
(2)锌铜稀硫酸原电池中,活泼金属锌作负极,锌失电子发生氧化反应,氢离子在正极铜上得电子发生还原反应;
(3)A烧杯中温度升高,该反应是放热反应;原电池将化学能转化成电能;
(4)A.原电池的本质是有电子转移;
B.原电池的构成条件必须有两个电极;
C.活泼金属作负极失电子发生氧化反应;
D.负极发生氧化反应,正极发生还原反应.
解答 解:(1)锌与氢离子反应生成锌离子与氢气,离子方程式为Zn+2H+═Zn2++H2↑,故答案为:Zn+2H+═Zn2++H2↑;
(2)锌铜稀硫酸原电池中,活泼金属锌作负极,电极反应为Zn-2e-═Zn2+,氢离子在正极铜上得电子产生氢气,电极反应为2H++2e-═H2↑,
故答案为:负;Zn-2e-═Zn2+;有无色气体产生;2H++2e-═H2↑;
(3)A烧杯中温度升高,该反应是放热反应,所以反应物总能量大于生成物总能量;该反应将化学能转化成热能,原电池是将化学能转化成电能,
故答案为:大于;热能;电能;
(4)A.原电池要有自发进行的氧化还原反应发生,一定有电子的转移,故A正确;
B.原电池的构成条件必须有两个电极,故B正确;
C.活泼金属作负极失电子发生氧化反应,正极上得电子发生还原反应,一般负极溶解,正极质量增重或析出气体,故C错误;
D.负极发生氧化反应,正极发生还原反应,故D正确;
故答案为:ABD.
点评 本题考查了反应热、原电池原理等知识点,明确反应物和生成物能量相对大小与反应热的关系、原电池构成条件即可解答,题目难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
| 温度/℃ | 1 000 | 1 150 | 1 300 |
| 平衡常数 | 4.0 | 3.7 | 3.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用食醋浸泡可除去水垢 | |
| B. | 用浓烧碱溶液作蚊虫叮咬处的淸洗剂 | |
| C. | 用明矾溶液的酸性淸除铜镜表面的铜锈 | |
| D. | 用浸泡过高锰酸钾溶液的硅土保存水果 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 稳定性:NH3>H2O>H2S | B. | 氧化性:Cl2>S>P | ||
| C. | 酸性:H3PO4>H2SO4>HClO4 | D. | 碱性:Mg(OH)2>Ca(OH)2>Ba(OH)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
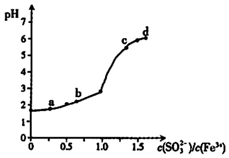 向FeCl3溶液中加入Na2SO3溶液,测定混合后溶液pH随混合前溶液中$\frac{c(S{O}_{3}^{2-})}{c(F{e}^{3+})}$变化的曲线如图所示.实验发现:
向FeCl3溶液中加入Na2SO3溶液,测定混合后溶液pH随混合前溶液中$\frac{c(S{O}_{3}^{2-})}{c(F{e}^{3+})}$变化的曲线如图所示.实验发现:| A. | 向a点溶液中滴加BaCl2溶液,无明显现象 | |
| B. | b点较a点溶液pH升高的主要原因:2Fe3++SO32-+H2O═2Fe2++SO42-+2H+ | |
| C. | c点溶液中发生的主要反应:2Fe3++3SO32-+6H2O?2Fe( OH)3+3H2SO3 | |
| D. | 向d点上层清液中滴加KSCN溶液,溶液变红;再滴加NaOH溶液,红色加深 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
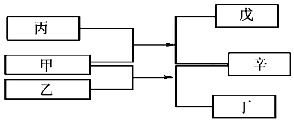 A、B、C、D是原子序数依次增大的四种短周期元素,甲、乙、丙、丁、戊是由其中的两种或三种元素组成的化合物,辛是由C元素形成的单质,常温常压下乙为液体.常温下,0.1mol/L 丁溶液的pH为13,上述各物质间的转化关系如图所示.下列说法正确的是( )
A、B、C、D是原子序数依次增大的四种短周期元素,甲、乙、丙、丁、戊是由其中的两种或三种元素组成的化合物,辛是由C元素形成的单质,常温常压下乙为液体.常温下,0.1mol/L 丁溶液的pH为13,上述各物质间的转化关系如图所示.下列说法正确的是( )| A. | 元素B、C、D的原子半径由大到小的顺序为 r(D)>r(C)>r(B) | |
| B. | 1L0.lmol/L戊溶液中阴离子的总物质的量小于0.1mol | |
| C. | 1mol甲与足量的乙完全反应共转移了约6.02×1023个电子 | |
| D. | 元素的非金属性B>C>A |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径Z>W>R | |
| B. | 对应的氢化物的热稳定性:R>W>Y | |
| C. | 单质Z可与R的最高价含氧酸发生置换反应 | |
| D. | W与R所形成的简单离子均能影响水的电离平衡 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 煤的气化、液化和石油的分馏均为物理变化 | |
| B. | 蛋白质水解生成氨基酸的反应属于取代反应 | |
| C. | 丙烷与氯气反应可得到沸点不同的4 种二氯代物 | |
| D. | 乙酸和硬脂酸(C17H35COOH)互为同系物 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com