
| T/K | 303 | 313 | 323 | 353 |
| NH3生成量/(10-6 mol) | 4.8 | 5.9 | 6.0 | 2.0 |
| 3 |
| 2 |
 ;氨气与次氯酸钠反应生成N2H4,次氯酸中氯元素有+1价变为-1价的氯离子,化合价降低了2价,氨气的氮元素化合价有-3价升高为-2价,升高了1价,所以氨气的计量数为2,次氯酸钠的计量数为1,根据观察法配平后的反应方程式为:2NH3+NaClO═N2H4+NaCl+H2O,
;氨气与次氯酸钠反应生成N2H4,次氯酸中氯元素有+1价变为-1价的氯离子,化合价降低了2价,氨气的氮元素化合价有-3价升高为-2价,升高了1价,所以氨气的计量数为2,次氯酸钠的计量数为1,根据观察法配平后的反应方程式为:2NH3+NaClO═N2H4+NaCl+H2O, ;2NH3+NaClO═N2H4+NaCl+H2O;
;2NH3+NaClO═N2H4+NaCl+H2O;| 1mol |
| 1mol+0.8832mol |
| 3 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
| 10-7×0.005 |
| 0.5a-0.005 |
| 10-9 |
| a-0.01 |
| 10-9 |
| a-0.01 |


科目:高中化学 来源: 题型:
| A、c(CH3COO-)>c(Na+) |
| B、c(CH3COO-)<c(Na+) |
| C、c(CH3COO-)=c(Na+) |
| D、无法确定c(CH3COO-)与c(Na+)的关系 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、乙醇的结构简式:CH3CH2OH |
B、HF的电子式: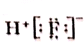 |
C、氯离子的结构示意图: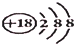 |
D、CH4分子的球棍模型: |
查看答案和解析>>
科目:高中化学 来源: 题型:
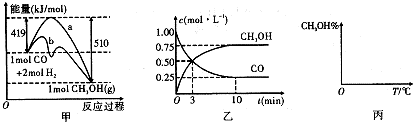
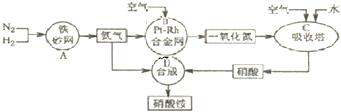
| n(CH3OH) |
| n(CO) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 3 |
| 2 |
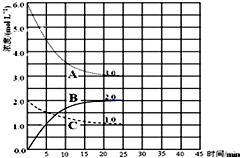
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 一根细如发丝的光缆可以同时传导上千部电话,是铜导线传导能力的约100倍左右.“光缆无铜,盗割有罪”.试问:光缆主要是以
一根细如发丝的光缆可以同时传导上千部电话,是铜导线传导能力的约100倍左右.“光缆无铜,盗割有罪”.试问:光缆主要是以查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com