
【题目】乙醇燃料电池采用硫酸作为电解质溶液,是一种可再生清洁的电池,电池的示意图如图,电池总反应式为C2H5OH+3O2=2CO2+3H2O。
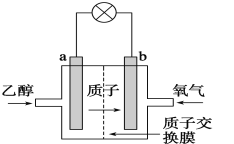
(1)a是___极(选“正”或“负”),发生___反应;电流由___极流向___极(选“a”或“b”),SO42-移向___极(选“a”或“b”)。
(2)随着电池的不断放电,硫酸溶液的物质的量浓度将___。(选“变大”或“不变”或“变小”)
(3)电池的负极电极反应式是___。
【答案】负 氧化 b a a 变小 C2H5OH-12e-+3H2O=2CO2+12H+
【解析】
由质子的移动方向可知a为负极,a极上是乙醇失电子发生氧化反应,乙醇被氧化生成CO2和H+,电极反应式为C2H5OH+3H2O-12e-═2CO2+12H+,b为正极,发生还原反应,电极方程式为4H++O2 +4e-═2H2O,以此解答该。
(1)由质子的移动方向可知a为负极,发生氧化反应;电池工作时,电流由正极经外电路流向负极,在该电池中由b极流向a极,电池中,阴离子向负极移动,所以SO42-向电池的a极迁移;
(2)电池的总反应为C2H5OH+3O2=2CO2+3H2O,随着电池的不断放电,硫酸溶液的物质的量浓度将变小;
(3)由质子的移动方向可知a为负极,乙醇失电子发生氧化反应,乙醇被氧化生成CO2和H+,电极反应式为C2H5OH-12e-+3H2O=2CO2+12H+。


 手拉手全优练考卷系列答案
手拉手全优练考卷系列答案科目:高中化学 来源: 题型:
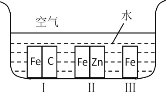
【题目】(1)如图所示,铁处于Ⅰ、Ⅱ、Ⅲ三种不同的环境中,铁被腐蚀的速率由大到小的顺序是(填序号)_______________。
(2)氟氯代烷是一种能破坏臭氧层的物质。在大气平流层中,氟氯代烷受紫外线的照射分解出氯原子,氯原子参与下列有关反应:①Cl+O3→ClO+O2 ②O3→O+O2 ③ClO+O→Cl+O2。上列的反应的总反应式是_________,少量氟氯代烷能破坏大量臭氧的原因是______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子在指定溶液能大量共存的是
A.pH=1的溶液中:Fe2+、NO3-、SO42-、Na+
B.由水电离的c(H+)=1×10-14mol·L-1的溶液中:Ca2+、K+、Cl-、HCO3-
C.![]() =1012的溶液中:NH4+、Al3+、NO3-、Cl-
=1012的溶液中:NH4+、Al3+、NO3-、Cl-
D.c(Fe3+)=0.1 mol·L-1的溶液中:K+、ClO-、SO42-、SCN-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值。下列说法正确的是
A.由13 g乙酸与2 g CO(NH2)2(尿素)形成的混合物中含有的氢原子总数为NA
B.标准状况下,体积均为2.24 L的CH4与H2O含有的电子总数均为NA
C.2 mol NO与1 mol O2在密闭容器中充分反应,产物的分子数为2NA
D.向1 L 1 mol·L-1 NaClO溶液中通入足量CO2,溶液中HClO的分子数为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二茂铁[Fe(C5H5)2]可作为燃料的节能消烟剂、抗爆剂。二茂铁的电化学制备装置与原理如图所示,下列说法正确的是
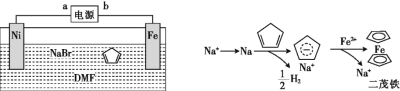
A.a为电源的负极
B.电解质溶液是NaBr水溶液和DMF溶液的混合液
C.电解池的总反应化学方程式为Fe+2C5H6![]() Fe(C5H5)2+H2↑
Fe(C5H5)2+H2↑
D.二茂铁制备过程中阴极的电极反应为2H++2e-![]() H2 ↑
H2 ↑
查看答案和解析>>
科目:高中化学 来源: 题型:
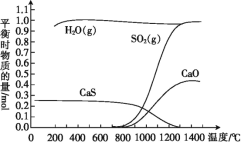
【题目】氢气还原石膏的过程会发生多个反应,其中主要反应为Ⅰ、Ⅱ、Ⅲ,当CaSO4(s)与H2(g)的起始物质的量之比为1∶1时,测得平衡时物质的量如图所示。
Ⅰ:CaSO4(s)+H2(g)![]() CaO(s)+H2O(g)+SO2(g) ΔH1>0
CaO(s)+H2O(g)+SO2(g) ΔH1>0
Ⅱ:CaSO4(s)+4H2(g)![]() CaS(s)+4H2O(g) ΔH2<0
CaS(s)+4H2O(g) ΔH2<0
Ⅲ:3CaSO4(s)+CaS(s)![]() 4CaO(s)+4SO2(g) ΔH3
4CaO(s)+4SO2(g) ΔH3
回答下列问题:
(1)100 ℃~700 ℃主要发生反应____(填“Ⅰ”“Ⅱ”或“Ⅲ”)。
(2)ΔH3=____(用含ΔH1、ΔH2的代数式表示),ΔH3____(填“>”或“<”)0,反应Ⅲ达到平衡后,升高温度,平衡____(填“正向”或“逆向”)移动。
(3)向某恒温恒容密闭容器中加入0.3 mol CaSO4和0.1 mol CaS,高温下若只发生反应Ⅲ,达到平衡时向容器中再充入少量SO2,下列说法正确的是____(填字母)。
A.重新平衡时,容器内气体总压强增大
B.重新平衡时,CaO的量减少
C.重新平衡时,SO2的浓度不变
D.CaSO4(s)、CaS(s)的质量不变
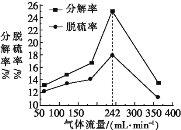
(4)其他条件一定时,H2的流量与石膏的分解率和脱硫率关系如图所示。在气体流量高于242 mL·min-1时,分解率和脱硫率均降低,可能的原因是____(只写一条)。
(5)已知其中副反应之一为2CaSO4(s)![]() 2CaO(s)+2SO2(g)+O2(g),在1625 K时,平衡常数Kp=1.45×10-5 atm3(atm表示大气压,
2CaO(s)+2SO2(g)+O2(g),在1625 K时,平衡常数Kp=1.45×10-5 atm3(atm表示大气压,![]() ≈3.81)。该温度下,反应CaO(s)+SO2(g)+
≈3.81)。该温度下,反应CaO(s)+SO2(g)+![]() O2(g)
O2(g) ![]() CaSO4(s)的K'p=____(保留整数部分)。
CaSO4(s)的K'p=____(保留整数部分)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某烃的衍生物W,仅含C、H、O三种元素.测其密度是相同条件下H2的45倍,各元素的质量百分含量如下表:
C% | H% | O% |
40.00% | 6.67% | 53.33% |
已知,W既能与乙酸反应,又能与乙醇反应,生成物都是酯和水。W的核磁共振氢谱图中有四种吸收峰,面积之比为3:1:1:1。
求:(1)W的相对分子质量为___;
(2)试计算确定W的分子式:___;
(3)W的结构简式为:___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙烯的分子式为C2H4,是一种重要的化工原料和清洁能源,研究乙烯的制备和综合利用具有重要意义。
请回答下列问题:
(1)乙烯的制备:工业上常利用反应C2H6(g)![]() C2H4(g)+H2(g) △H制备乙烯。
C2H4(g)+H2(g) △H制备乙烯。
已知:Ⅰ.C2H4(g)+3O2(g)=2CO2(g)+2H2O(l) △H1=-1556.8kJ·mol-1;
Ⅱ.H2(g)+![]() O2(g)=H2O(1) △H2=-285.5kJ·mol-1;
O2(g)=H2O(1) △H2=-285.5kJ·mol-1;
Ⅲ.C2H6(g)+![]() O2(g)=2CO2(g)+3H2O(l) △H3=-1559.9kJ·mol-1。
O2(g)=2CO2(g)+3H2O(l) △H3=-1559.9kJ·mol-1。
则△H=___kJ·mol-1。
(2)乙烯可用于制备乙醇:C2H4(g)+H2O(g)![]() C2H5OH(g)。向某恒容密闭容器中充入a mol C2H4(g)和 a mol H2O(g),测得C2H4(g)的平衡转化率与温度的关系如图所示:
C2H5OH(g)。向某恒容密闭容器中充入a mol C2H4(g)和 a mol H2O(g),测得C2H4(g)的平衡转化率与温度的关系如图所示:
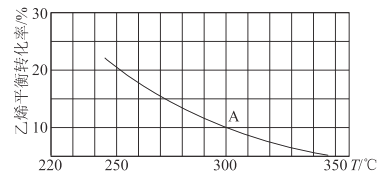
①该反应为____热反应(填“吸”或“放”),理由为____。
②A点时容器中气体的总物质的量为____。已知分压=总压×气体物质的量分数,用气体分压替代浓度计算的平衡常数叫压强平衡常数(KP),测得300℃时,反应达到平衡时该容器内的压强为b MPa,则A点对应温度下的KP=____MPa-1(用含b的分数表示)。
③已知:C2H4(g)+H2O(g)![]() C2H5OH(g)的反应速率表达式为v正=k正c(C2H4)·c(H2O),v逆=k逆c(C2H5OH),其中,k正、k逆为速率常数,只与温度有关。则在温度从250℃升高到340℃的过程中,下列推断合理的是___(填选项字母)。
C2H5OH(g)的反应速率表达式为v正=k正c(C2H4)·c(H2O),v逆=k逆c(C2H5OH),其中,k正、k逆为速率常数,只与温度有关。则在温度从250℃升高到340℃的过程中,下列推断合理的是___(填选项字母)。
A.k正增大,k逆减小 B.k正减小,k逆增大
C.k正增大的倍数大于k逆 D.k正增大的倍数小于k逆
④若保持其他条件不变,将容器改为恒压密闭容器,则300℃时,C2H4(g)的平衡转化率__10%(填“>”“<”或“=”)。
(3)乙烯可以被氧化为乙醛(CH3CHO),电解乙醛的酸性水溶液可以制备出乙醇和乙酸,则生成乙酸的电极为_____极(填“阴”或“阳”),对应的电极反应式为___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com