



 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:阅读理解
查看答案和解析>>
科目:高中化学 来源:2013届湖南省湘中名校高三9月第一次联考化学试卷(带解析) 题型:实验题
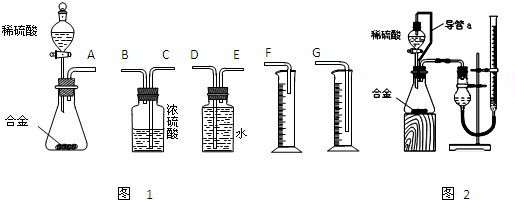
(每空2分,共16分)铝镁合金已成为飞机制造、化工生产等行业的重要材料。研究性学习小组的同学,为测定某含镁3%-5%的铝镁合金(不含其它元素)中镁的质量分数,设计下列两种不同实验方案进行探究。填写下列空白。 [方案一]
[方案一] 〖实验方案〗将铝镁合金与足量NaOH溶液反应,测定剩余固体质量。
〖实验方案〗将铝镁合金与足量NaOH溶液反应,测定剩余固体质量。 实验中发生反应的化学方程式是 。
实验中发生反应的化学方程式是 。 〖实验步骤〗
〖实验步骤〗 (1)称取5.4g铝镁合金粉末样品,溶于V mL 2.0 mol/L NaOH溶液中。为使其反应完全,则NaOH溶液的体积V ≥ 。
(1)称取5.4g铝镁合金粉末样品,溶于V mL 2.0 mol/L NaOH溶液中。为使其反应完全,则NaOH溶液的体积V ≥ 。 (2)过滤、洗涤、干燥、称量固体。该步骤中若未洗涤固体,测得镁的质量分数将
(2)过滤、洗涤、干燥、称量固体。该步骤中若未洗涤固体,测得镁的质量分数将  (填“偏高”、“偏低”或“无影响”)。
(填“偏高”、“偏低”或“无影响”)。 [方案二
[方案二
 ]
]
〖实验方案〗将铝镁合金与足量稀硫酸溶液反应,测定生成气体在通常状况(约20℃,1.01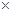 105Pa)的体积。
105Pa)的体积。 〖问题讨论〗(1)同学们拟选用下列实验装置完成实验:
〖问题讨论〗(1)同学们拟选用下列实验装置完成实验:






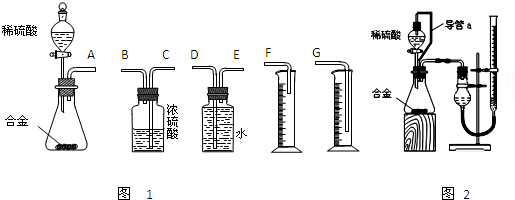
 ①你认为最简易的装置其连接顺序是:a接( )( )接( )( )接( )(填接口字母,可不填满。)
①你认为最简易的装置其连接顺序是:a接( )( )接( )( )接( )(填接口字母,可不填满。) ②实验开始时,先打开分液漏斗上口的玻璃塞,再轻轻打开分液漏斗可旋转的活塞,一会儿后稀硫酸也不能顺利滴入锥形瓶中。请你帮助分析原因 。
②实验开始时,先打开分液漏斗上口的玻璃塞,再轻轻打开分液漏斗可旋转的活塞,一会儿后稀硫酸也不能顺利滴入锥形瓶中。请你帮助分析原因 。 ③实验结束时,在读取测量实验中生成氢气的体积时,你认为最合理的顺序是 。
③实验结束时,在读取测量实验中生成氢气的体积时,你认为最合理的顺序是 。
A.等待实验装置冷却 | B.上下移动量筒f,使其中液面与广口瓶中液面相平 | C.上下移动量筒g,使其中液面与广口瓶中液面相平 | D.视线与凹液面的最低点水平读取量筒中水的体积 |
 (2)仔细分析实验装置后,同学们经讨论认为以下两点会引起较大误差:稀硫酸滴入锥形瓶中,即使不生成氢气,也会将瓶内空气排出,使所测氢气体积偏大;实验结束时,连接广口瓶和量筒的导管中有少量水存在,使所测氢气体积偏小。于是他们设计了右图所示的实验装置。
(2)仔细分析实验装置后,同学们经讨论认为以下两点会引起较大误差:稀硫酸滴入锥形瓶中,即使不生成氢气,也会将瓶内空气排出,使所测氢气体积偏大;实验结束时,连接广口瓶和量筒的导管中有少量水存在,使所测氢气体积偏小。于是他们设计了右图所示的实验装置。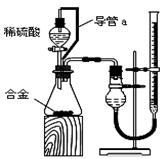
 ①装置中导管a的作用是 。
①装置中导管a的作用是 。 ②实验前后碱式滴定管中液面读数分别为V1 mL、V2 mL。则产生氢气的体积为_________mL。
②实验前后碱式滴定管中液面读数分别为V1 mL、V2 mL。则产生氢气的体积为_________mL。



查看答案和解析>>
科目:高中化学 来源:2012-2013学年湖南省名校高三9月第一次联考化学试卷(解析版) 题型:实验题
(每空2分,共16分) 铝镁合金已成为飞机制造、化工生产等行业的重要材料。研究性学习小组的同学,为测定某含镁3%-5%的铝镁合金(不含其它元素)中镁的质量分数,设计下列两种不同实验方案进行探究。填写下列空白。
 [方案一]
[方案一]
〖实验方案〗将铝镁合金与足量NaOH溶液反应,测定剩余固体质量。 实验中发生反应的化学方程式是
。
实验中发生反应的化学方程式是
。
〖实验步骤〗
 (1)称取5.4g铝镁合金粉末样品,溶于V mL 2.0 mol/L
NaOH溶液中。为使其反应完全,则NaOH溶液的体积V ≥ 。
(1)称取5.4g铝镁合金粉末样品,溶于V mL 2.0 mol/L
NaOH溶液中。为使其反应完全,则NaOH溶液的体积V ≥ 。
(2)过滤、洗涤、干燥、称量固体。该步骤中若未洗涤固体,测得镁的质量分数将 (填“偏高”、“偏低”或“无影响”)。
 [方案二
[方案二 ]
]
〖实验方案〗将铝镁合金与足量稀硫酸溶液反应,测定生成气体在通常状况(约20℃,1.01 105Pa)的体积。
105Pa)的体积。
 〖问题讨论〗(1)同学们拟选用下列实验装置完成实验:
〖问题讨论〗(1)同学们拟选用下列实验装置完成实验:




 ①你认为最简易的装置其连接顺序是:a接( )( )接( )( )接( )(填接口字母,可不填满。)
①你认为最简易的装置其连接顺序是:a接( )( )接( )( )接( )(填接口字母,可不填满。)
②实验开始时,先打开分液漏斗上口的玻璃塞,再轻轻打开分液漏斗可旋转的活塞,一会儿后稀硫酸也不能顺利滴入锥形瓶中。请你帮助分析原因 。
 ③实验结束时,在读取测量实验中生成氢气的体积时,你认为最合理的顺序是
。
③实验结束时,在读取测量实验中生成氢气的体积时,你认为最合理的顺序是
。
A.等待实验装置冷却
 B.上下移动量筒f,使其中液面与广口瓶中液面相平
B.上下移动量筒f,使其中液面与广口瓶中液面相平
C.上下移动量筒g,使其中液面与广口瓶中液面相平
 D.视线与凹液面的最低点水平读取量筒中水的体积
D.视线与凹液面的最低点水平读取量筒中水的体积
(2)仔细分析实验装置后,同学们经讨论认为以下两点会引起较大误差:稀硫酸滴入锥形瓶中,即使不生成氢气,也会将瓶内空气排出,使所测氢气体积偏大;实验结束时,连接广口瓶和量筒的导管中有少量水存在,使所测氢气体积偏小。于是他们设计了右图所示的实验装置。

 ①装置中导管a的作用是
。
①装置中导管a的作用是
。
②实验前后碱式滴定管中液面读数分别为V1 mL、V2
mL。则产生氢气的体积为_________mL。

查看答案和解析>>
科目:高中化学 来源:2010-2011学年吉林省高三第一次模拟化学试卷 题型:实验题
(14分)铝镁合金已成为飞机制造、化工生产等行业的重要材料。研究性学习小组的同学,为测定某含镁4%~6%的铝镁合金(不含其它元素)中镁的质量分数,设计了多种实验方案,其中之一是:将铝镁合金与足量NaOH溶液反应,测定剩余固体质量。按要求填写下列空白:
1.称取5.4g铝镁合金粉末样品,溶于V mL 2.0 mol/L NaOH溶液中。
⑴实验中发生反应的化学方程式是 。
⑵为使其反应完全,则NaOH溶液的体积V ≥ mL。
2.过滤、洗涤、干燥、称量固体。该步骤中若未洗涤固体,测得镁的质量分数将 。
(填“偏高”、“偏低”或“无影响”)。
3. NaOH溶液的浓度可用稀硫酸测定,欲用质量分数98%(密度为1.84 g/cm3)的浓硫酸配制3 mol/L的稀硫酸100 mL。回答下列问题:
⑴需要用量筒量取浓硫酸 mL。
⑵配制操作可分解成如下几步,正确的操作顺序是 。
A.继续往容量瓶中小心地加蒸馏水,使液面接近刻度线1~2cm时。
B.用少量蒸馏水洗涤烧杯及玻璃棒,将溶液注入容量瓶,并重复操作两次。
C.将冷却的稀硫酸转移到容量瓶中。
D.根据计算,用量筒取一定体积的浓硫酸。
E.将浓硫酸沿烧杯壁慢慢注入盛有蒸馏水的小烧杯中,并不断用玻璃棒搅拌。
F.盖上容量瓶塞子,振荡,摇匀。
G.用胶头滴管加蒸馏水,使溶液凹液面恰好与刻度线相切
⑶下列操作,使制得的稀硫酸溶液浓度偏小的是 (填写编号)。
A.用量筒量取一定液体时,俯视液面读数。
B.在容量瓶定容时俯视刻度线。
C.转移溶液后未洗涤烧杯和玻璃棒。
D.容量瓶刚用蒸馏水洗净,没有烘干。
E.定容时,滴加蒸馏水,先使液面略高于刻度线,再吸出少量水使液面凹面与刻度线相切。
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com