
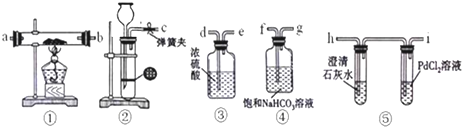
分析 (1)根据实验目的:探究钠与CO2的反应,设计实验方案,完成正确的仪器连接顺序,②为制取二氧化碳装置,实验室中常用碳酸钙与盐酸反应,二氧化碳中混有氯化氢,需要用装置④除去,然后用装置③干燥,然后在①中进行钠与二氧化碳的反应,然后用⑤检验反应产物,据此进行连接装置;
(2)所选试剂的作用是增大溶液体积,可以用稀硝酸溶液,由于硫酸和碳酸钙反应生成硫酸钙微溶覆盖在碳酸钙表面阻止反应进一步发生不选,四氯化碳的密度大于盐酸,也可以加入四氯化碳溶液,但是苯的密度小于盐酸,加入苯不能使稀盐酸与碳酸钙接触;
(3)二氧化碳与澄清石灰水反应生成碳酸钙沉淀,当装置⑤中澄清石灰水变浑浊说明装置中空气已经排净;原因是空气中的二氧化碳、水与钠反应,需要排净空气,避免干扰实验;
(4)根据氧化钠与二氧化碳反应生成碳酸钠分析;
Ⅰ.根据题干信息及反应现象判断反应物、生成物,然后写出反应的化学方程式;
Ⅱ.根据n=$\frac{m}{M}$计算出钠的物质的量,再根据n=$\frac{V}{22.4L/mol}$计算出标况下224mL二氧化碳的物质的量,从而得出反应后生成碳酸钠的物质的量;溶液中还有固体残留,该固体只能为C,说明钠与二氧化碳反应生成碳酸钠和C,据此写出反应的化学方程式.
解答 解:(1)探究钠与CO2的反应,首先用盐酸和碳酸钙在②中反应制取二氧化碳气体,制取的二氧化碳中混有挥发出来的HCl,需要用装置④中的饱和碳酸氢钠溶液除去HCl,然后用③浓硫酸干燥,再在①中进行钠与二氧化碳的反应,最后用装置⑤检验反应产物,所以装置的连接顺序为:g、d、e、a(b)、b(a)、h,
故答案为:g 接 d,e 接 a(或b),b(或a) 接 h;
(2)A.H2SO4溶液:加入H2SO4溶液后,增大了盐酸的体积,但硫酸和碳酸钙反应生成硫酸钙微溶覆盖在碳酸钙表面阻止反应进一步发生,故A错误;
B.CCl4:四氯化碳的密度大于稀盐酸,加入四氯化碳后会,四氯化碳层在混合液下层,从而使盐酸与碳酸钙接触,故B正确;
C.苯:苯的密度小于盐酸,加入苯后,苯在混合液上层,无法使稀盐酸与碳酸钙接触,故C错误;
D.稀硝酸:加入稀硝酸后,可以增大溶液体积,使溶液与碳酸钙接触,故D正确;
故答案为:BD;
(3)钠化学性质比较活泼,能够与空气中的氧气、水反应,所以点燃酒精灯之前应需要打开弹簧夹,让CO2充满整个装置,以便排尽装置中的空气,避免空气中O2、H2O干扰实验;当装置装置⑤中澄清石灰水变浑浊时,证明装置中空气已经排净,
故答案为:装置⑤中澄清石灰水开始变浑浊;
(4)因为氧化钠与二氧化碳反应生成碳酸钠,所以反应过程中CO2足量,探究钠与CO2充分反应不可能生成氧化钠固体,故①②可能,③④不可能;
故答案为:①②;
Ⅰ.装置⑤PdCl2溶液中观察到有黑色沉淀,PdCl2能被CO还原得到黑色的Pd,则黑色沉淀为Pd,钠与二氧化碳反应生成了CO;装置①中固体成分只有一种,且向固体中加入稀盐酸产生能使澄清石灰水变浑浊的气体,该气体为二氧化碳,则钠与二氧化碳反应生成碳酸钠和CO,2Na+2CO2$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO,
故答案为:2Na+2CO2$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO;
Ⅱ.装置①中钠的质量为0.46g,钠的物质的量为:n(Na)=$\frac{0.46g}{23g/mol}$=0.02mol,
将装置①中的固体加入到足量稀盐酸中产生224mL(标准状况)CO2气体,二氧化碳的物质的量为:n(CO2)=$\frac{0.224L}{22.4L/mol}$=0.01mol,则反应后生成碳酸钠的物质的量为0.01mol,说明钠完全转化成了碳酸钠;
溶液中还有固体残留,根据化合价变化可知,残留的固体只能为C,则钠与二氧化碳反应生成了碳酸钠和C,反应的化学方程式为:4Na+3CO2$\frac{\underline{\;\;△\;\;}}{\;}$2Na2CO3+C,
故答案为:4Na+3CO2$\frac{\underline{\;\;△\;\;}}{\;}$2Na2CO3+C.
点评 本题通过探究钠与CO2的反应,考查了性质实验方案的设计原则,题目难度中等,正确理解题干信息为解答关键,注意掌握性质实验方案的设计原则,(4)为易错点,需要根据题中信息及反应现象判断反应物、生成物,试题充分考查了学生的分析、理解能力及综合应用所学知识的能力.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯气、明矾净水原理相同 | |
| B. | 过氧化钠、活性炭均可用于呼吸面具 | |
| C. | 硅胶和铁粉均可用于食品的防氧化 | |
| D. | 甲烷的氯代物均可作防火材料 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
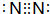 .试写出由上述元素组成的分子中含有4个原子核且为18电子结构的物质的化学式H2O2.
.试写出由上述元素组成的分子中含有4个原子核且为18电子结构的物质的化学式H2O2.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲烷的燃烧热△H=-890.3kJ/mol,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=-890.3 kJ/mol | |
| B. | 一定条件下,将0.5 mol N2和1.5 molH2置于密闭容器中充分反应生成NH3放热19.3kJ,其热化学方程式为:N2(g)+3H2(g)?2NH3(g)△H=-38.6 kJ/mol | |
| C. | 在101kPa时,2gH2完全燃烧生成液态水,放出285.8 kJ热量,氢气燃烧的热化学方程式表示为:2H2(g)+O2(g)═2H2O(l)△H=-571.6 kJ/mol | |
| D. | HCl和NaOH反应的中和热△H=-57.3 kJ/mol,则H2SO4和Ba(OH)2反应的中和热△H=2×(-57.3)kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 分类标准 | 酸性氧化物 | 能导电 | 电解质 |
| 属于该类的物质 | ③④ | ②⑦⑧⑨ | ⑤⑥⑨ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铅笔芯的原材料为铅,儿童使用铅笔时如果用嘴吮吸能够引起铅中毒 | |
| B. | “轻轨电车”是一种交通工具,当电车启动时,电车电刷与导线的接触点上由于摩擦会产生高温,因此接触点上的材料应该选用耐高温、能导电的物质,石墨恰好合适 | |
| C. | 为防止中秋月饼等富含脂质食品氧化变质,常在包装袋中放入生石灰 | |
| D. | 双氧水是绿色氧化剂,可作医疗消毒剂,说明H2O2对人体无害 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 有A、D、E、G、M、L六种前四周期的元素.A是宇宙中最丰富的元素.D原子核外有1个未成对电子,D+比E原子少一个电子层,E原子得一个电子填入3p轨道后,3p轨道呈全充满状态.G原子的2p轨道有2个未成对电子,M的最高化合价和最低化合价的代数和为4,与G的原子序数相差8.L位于周期表第12纵行且是六种元素中原子序数最大的.R是由M、L形成的化合物,其晶胞结构如图所示.请回答下列问题:
有A、D、E、G、M、L六种前四周期的元素.A是宇宙中最丰富的元素.D原子核外有1个未成对电子,D+比E原子少一个电子层,E原子得一个电子填入3p轨道后,3p轨道呈全充满状态.G原子的2p轨道有2个未成对电子,M的最高化合价和最低化合价的代数和为4,与G的原子序数相差8.L位于周期表第12纵行且是六种元素中原子序数最大的.R是由M、L形成的化合物,其晶胞结构如图所示.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C2H4 | B. | C2H2 | C. | C3H4 | D. | C4H6 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com