
分析 (1)依据热化学方程式和盖斯定律计算得到;
(2)负极通入丙烷,碳元素的化合价升高,电池的正极通入O2,氧元素的化合价降低,以此书写电极反应,电解质溶液中阴离子向负极移动;
(3)弱酸电离平衡常数等于平衡状态离子平衡浓度幂次方乘积除以的弱电解质平衡浓度达到.
解答 解:(1)①C3H8(g)→CH4(g)+HC≡CH(g)+H2(g)△H1=156.6kJ•mol-1
②CH3CH=CH2(g)→CH4(g)+HC≡CH(g)△H2=32.4kJ•mol-1
依据盖斯定律①-②得到C3H8(g)→CH3CH=CH2(g)+H2(g)△H=+124.2KJ/mol
则相同条件下,反应C3H8(g)→CH3CH=CH2(g)+H2(g)△H=+124.2KJ/mol;
故答案为:+124.2;
(2)燃料电池中,负极上燃料失电子发生氧化反应,正极上氧化剂得电子发生还原反应,负极电极反应式为C3H8-20e-+10CO32-=13CO2+4H2O,正极反应式为:O2+2CO2+4e-=2CO32-,所以其电池反应式为C3H8+5O2═3CO2+4H2O,原电池中阴离子向负极移动,即CO32-移向电池的负极,
故答案为:C3H8+5O2═3CO2+4H2O;负;
(3)碳氢化合物完全燃烧生成CO2和H2O.常温常压下,空气中的CO2溶于水,达到平衡时,溶液的pH=5.60,c(H+)=c(HCO3-)=10-5.6mol/L,c(H2CO3)=1.5×10-5 mol•L-1.若忽略水的电离及H2CO3的第二级电离,则H2CO3?HCO3-+H+的电离平衡常数Ka1=$\frac{c({H}^{+})c(HC{{O}_{3}}^{-})}{c({H}_{2}C{O}_{3})}$=$\frac{1{0}^{-5.6}×1{0}^{-5.6}}{1.5×1{0}^{-5}}$=$\frac{2.5×1{0}^{-6}×2.5×1{0}^{-6}}{1.5×1{0}^{-5}}$=4.2×10-7;
故答案为:4.2×10-7.
点评 本题考查了热化学方程式和盖斯定律计算应用,原电池原理,弱电解质平衡常数计算和电离度计算应用,掌握基础是关键,题目难度中等.


科目:高中化学 来源: 题型:选择题
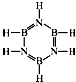 已知化合物B3N3H6(硼氮苯)与C6H6(苯)为等电子体,分子结构如图.则硼氮苯的四氯取代物B3N3H2Cl4的同分异构体的数目为( )
已知化合物B3N3H6(硼氮苯)与C6H6(苯)为等电子体,分子结构如图.则硼氮苯的四氯取代物B3N3H2Cl4的同分异构体的数目为( )| A. | 3 | B. | 4 | C. | 5 | D. | 6 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | LiH、LiD、LiT的摩尔质量之比为1:2:3 | |
| B. | 一个T原子的质量约为$\frac{2}{6.02}$×1023g | |
| C. | H、D、T的中子数之比为1:2:3 | |
| D. | 氕化锂、氘化锂、氚化锂都是强还原剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电池放电时,溶液中的阳离子移向正极 | |
| B. | 电池放电时,H2是正极 | |
| C. | 电池充电时,氢元素被氧化 | |
| D. | 电池放电时,电池负极周围溶液的pH不断增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1H218O与D216O的相对分子质量相同 | |
| B. | H2O与D2O互称同素异形体 | |
| C. | 氘(D)原子核外有1个电子 | |
| D. | 1H与D互为同位素 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 压强(KPa) | 200 | 500 | 1000 |
| B的浓度(mol/L) | 0.04 | 0.1 | 0.27 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
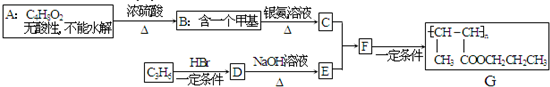
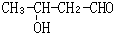 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
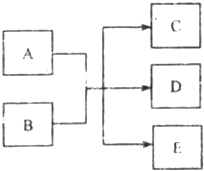 一定条件下,物质A~E转化关系如图,其中A为单质,常温下E为无色液体.
一定条件下,物质A~E转化关系如图,其中A为单质,常温下E为无色液体.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com