
【题目】化学与生活密切相关。
I.K2Cr2O7曾用于检测司机是否酒后驾驶:Cr2O72-(橙色)+CH3CH2OH→Cr3+(绿色)+CH3COOH(未配平)
(1)基态Cr原子的价电子轨道表达式为__。
(2)CH3COOH分子中所含元素的电负性由大到小的顺序为__,碳原子的轨道杂化类型为__,所含σ键与π键的数目之比为__。
(3)已知Cr3+等过渡元素水合离子的颜色如表所示:
离子 | Sc3+ | Cr3+ | Fe2+ | Zn2+ |
水合离子的颜色 | 无色 | 绿色 | 浅绿色 | 无色 |
请根据原子结构推测Sc3+、Zn2+的水合离子为无色的原因为__。
II.ZnCl2浓溶液常用于除去金属表面的氧化物,例如与FeO反应可得Fe[Zn(OH)Cl2]2溶液。
(4)Fe[Zn(OH)Cl2]2溶液中不存在的微粒间作用力有__(填选项字母);
A.离子键 B.共价键 C.金属键 D.配位键 E.范德华力 F.氢键
溶液中[Zn(OH)Cl2]-的结构式为__。
III.锌是人体必需的微量元素之一,其堆积方式如图1,晶胞结构如图2。

(5)锌的堆积方式为__,配位数为__。
(6)若锌原子的半径为apm,阿伏加德罗常数的值为NA,则锌晶体的密度为___g/cm3(用含a的代数式表示)。
【答案】![]() O>C>H sp3和sp2 7:1 3d轨道上没有未成对电子(3d轨道上电子为全空或全满) AC
O>C>H sp3和sp2 7:1 3d轨道上没有未成对电子(3d轨道上电子为全空或全满) AC  或
或 六方最密堆积 12
六方最密堆积 12 ![]() 或
或![]()
【解析】
(1)基态Cr原子的的原子序数是24,价电子排布式为3d54s1;
(2)电负性是原子对键合电子的吸引力的大小;对于碳原子,碳碳单键是sp3杂化,碳碳双键和碳氧双键是sp2杂化,三键是sp杂化;单键都是σ键,双键中一个是σ键,一个是π键;
(3)根据电子排布式可推测离子有无颜色;
(4)Fe[Zn(OH)Cl2]2在溶液中以阴阳离子的形式存在,没有离子键,Fe[Zn(OH)Cl2]2是配合物,存在共价键、配位键,水分子间还有范德华力和氢键;[Zn(OH)Cl2]-中Zn提供空轨道,氯原子和氧原子提供孤对电子形成配位键。
(5)从锌的堆积方式图可以看出,锌的堆积方式为六方最密堆积,最密堆积的配位数为12;
(6)若锌原子的半径为a pm,中间的锌原子和底面的三个锌原子构成了正四面体,正四面体的边长为2a,用立体几何的知识求出晶胞的体积,用均摊法求出锌原子个数,进而求出锌晶体的密度。
(1)基态Cr原子的原子序数是24,价电子排布式为3d54s1,则价电子轨道表达式为![]() ,故答案为:
,故答案为:![]() ;
;
(2) 非金属性越强,电负性越大,则CH3COOH分子中所含元素的电负性由大到小的顺序为O>C>H;对于碳原子,碳碳单键是sp3杂化,碳碳双键和碳氧双键是sp2杂化,三键是sp杂化,则CH3COOH分子中甲基的饱和碳原子为sp3杂化,羧基的碳原子的轨道杂化类型为sp2;单键都是σ键,双键中含有1个σ键和1个π键,则CH3COOH分子中含由σ键与π键的数目之比为7:1,故答案为:O>C>H;sp3和sp2;7:1;
(3)由Sc3+、Cr3+、Fe2+、Zn2+离子的核外电子排布式分别为1s22s22p63s23p6、1s22s22p63s23p63d2、1s22s22p63s23p63d6、1s22s22p63s23p63d10可知,过渡元素水合离子的颜色与d轨道上未成对电子有关,水合离子为无色的Sc3+的3d轨道上电子为全空、Zn2+的3d轨道上电子为全满,故答案为:3d轨道上没有未成对电子(3d轨道上电子为全空或全满);
(4)Fe[Zn(OH)Cl2]2的水溶液中存在Fe2+和[Zn(OH)Cl2]—离子, [Zn(OH)Cl2]-离子中存在共价键、配位键,水分子间还有范德华力和氢键,则溶液中不存在离子键和金属键;[Zn(OH)Cl2]-中Zn提供空轨道,氯原子和氧原子提供孤对电子,则溶液中[Zn(OH)Cl2]-的结构式为 或
或  ,故答案为:AC;
,故答案为:AC; 或
或  ;
;
(5)根据图1锌的堆积方式图可知,锌的堆积方式为六方最密堆积,最密堆积的配位数为12,故答案为:六方最密堆积;12;
![]() +1=2,则晶胞质量为
+1=2,则晶胞质量为![]() g,若锌原子的半径为a pm,中间的锌原子和底面的三个锌原子构成了正四面体,正四面体的边长为2a pm,则晶胞的底面积是2apm×(2a×sin60°)pm=
g,若锌原子的半径为a pm,中间的锌原子和底面的三个锌原子构成了正四面体,正四面体的边长为2a pm,则晶胞的底面积是2apm×(2a×sin60°)pm=![]() 2 pm2,晶胞的高为
2 pm2,晶胞的高为![]() pm=
pm=![]() pm ,体积是
pm ,体积是![]() 2 pm2×
2 pm2×![]() pm=
pm=![]() 3 pm3,由此可知晶胞的密度为
3 pm3,由此可知晶胞的密度为![]() ,故答案为:
,故答案为:![]() 或
或![]() 。
。


科目:高中化学 来源: 题型:
【题目】我国科学家研发了一种室温下“可呼吸”的Na—CO2二次电池。将NaClO4溶于有机溶剂作为电解液,钠和负载碳纳米管的镍网分别作为电极材料,电池的总反应为:3CO2+4Na![]() 2Na2CO3+C。下列说法错误的是
2Na2CO3+C。下列说法错误的是
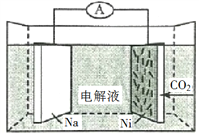
A. 放电时,ClO4-向负极移动
B. 充电时释放CO2,放电时吸收CO2
C. 放电时,正极反应为:3CO2+4e =2CO32-+C
D. 充电时,正极反应为:Na++e=Na
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳及其化合物广泛存在于自然界中。回答下列问题:
(1)基态碳原子核外有________种能量不同的电子, 其核外电子运动状态由_____ 种因素决定。
(2)CH4分子间不能形成氢键, 主要原因是CH4 分子中的碳原子不含孤对电子、_____ 、 _____________。
(3)碳酸的非羟基氧的个数和磷酸的非羟基氧的个数都是1, 从结构上分析,它们的强度 相近,均为中强酸。然而事实上二氧化碳水溶液的酸性却很弱,原因是__________。
(4)乙二胺(H2NCH2CH2NH2)是 一种有机化合物, N 原子的杂化轨道类型为______,乙二胺通过配位键能与Cu2+ 形成稳定的环状配离子,其结构可表示为__________。
(5)金刚石是碳的一种同素异形体,属于_______ 晶体。已知金属钠的晶胞(体心立方堆积)沿其体对角线垂直在纸平面上的投影图如图A 所示,则金刚石晶胞沿其体对角线垂直在纸平面上的投影图应该是下图 ___________(从 A~D 图中选填).
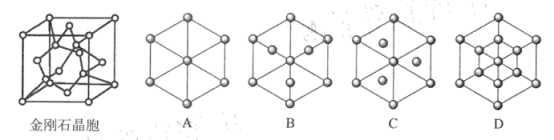
若碳原子半径为r ,金刚石晶胞中碳原子的空间占有率为_____________( 用含π 的代数.式表示).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知镓是铝同族下一周期的元素。砷化镓的晶胞结构如图所示。试回答:
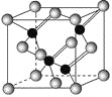
(1)镓的基态原子的电子排布式是______。
(2)砷化镓晶胞中所包含的砷原子(白色球)个数为___,与同一个镓原子相连的砷原子构成的空间构型为____。
(3)N、P、As处于同一主族,其氢化物沸点由高到低的顺序是___ (用氢化物分子式表示)。
(4)砷化镓可由(CH3)3Ga和AsH3在700 ℃时制得。(CH3)3Ga中镓原子的杂化方式为____。
(5)比较二者的第一电离能:As____Ga(填“<”、“>”或“=”)。
(6)下列说法正确的是__(填字母)。
A.砷化镓晶胞结构与NaCl相同 B.电负性:As>Ga C.砷化镓晶体中含有配位键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以含钴废催化剂(主要成分为Co、Fe、SiO2)为原料,制取氧化钴的流程如下:
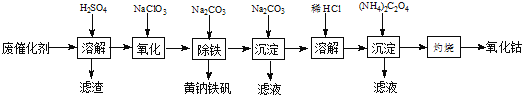
(1)溶解:溶解后过滤,将滤渣洗涤2~3次,洗液与滤液合并,其目的是_________________,所得滤渣的主要成分是_________(写化学式)。
(2)氧化:加热搅拌条件下加入NaClO3,将Fe2+氧化成Fe3+,其离子方程式_________________。
已知:铁氰化钾化学式为K3[Fe(CN)6];亚铁氰化钾化学式为K4[Fe(CN)6]3H2O.
3Fe2++2[Fe(CN)6]3-=Fe3[Fe(CN)6]2↓(蓝色沉淀)
4Fe3++3[Fe(CN)6]4-=Fe4[Fe(CN)6]3↓(蓝色沉淀)
确定Fe2+是否氧化完全的方法是______________。(可供选择的试剂:铁氰化钾溶液、亚铁氰化钾溶液、铁粉、KSCN溶液)
(3)除铁:加入适量的Na2CO3调节酸度,生成黄钠铁矾[Na2Fe6(SO4)4(OH)12]沉淀,写出该反应的化学方程式______________。
(4)沉淀:生成沉淀碱式碳酸钴[(CoCO3)23Co(OH)2],沉淀需洗涤,洗涤的操作是______________。
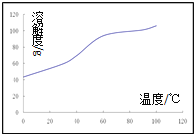
(5)溶解:CoCl2的溶解度曲线如图所示向碱式碳酸钴中加入足量稀盐酸,边加热边搅拌至完全溶解后,需趁热过滤,其原因是______________。
(6)灼烧:准确称取所得CoC2O41.470g,在空气中充分灼烧得0.830g氧化钴,写出氧化钴的化学式_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】石油是工业的血液,与我们的生产、生活息息相关。
(1)乙烯是石油化工重要的基础原料。 写出乙烯的电子式____________
(2)分子式为C5H12的某烃,分子中含有4个甲基,该烃的结构简式为_______________________。
(3)与乙烯互为同系物的是_______ 。(选填编号)
a. CH3CH=CH2 b. CH2=CHCH=CH2
c. CH≡CH d. CH3CH3
(4)聚乙烯安全无毒,可用于制食品包装袋。聚乙烯的结构简式为 ________________ 。
(5)乙炔三聚可得到苯或二乙烯基乙炔 (CH2=CH-C-C-CH=CH2) 。鉴别苯和二乙烯基乙炔可用的试剂是__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】四氢呋喃是常用的有机溶剂,可由有机物A(分子式:C4H8O)通过下列路线制得

已知:R1X + R2OH![]() R1OR2 + HX
R1OR2 + HX
下列说法不正确的是
A. C中含有的官能团仅为醚键 B. A的结构简式是CH3CH=CHCH2OH
C. D和E均能使酸性高锰酸钾溶液褪色 D. ①③的反应类型分别为加成反应、消去反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2与ICl的反应分①、②两步进行,其能量曲线如下图所示,下列有关说法不正确的是( )
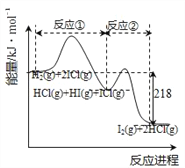
A. 反应②比①要容易发生是因为反应②活化能大
B. 反应①和②均为放热反应
C. H2(g)+2ICl(g)= I2(g)+2HCl(g) H= -218 kJ·molˉ1
D. 反应①和②均为氧化还原反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com