
��14�֣���ҵ����������β���ŷų���SO2��NOx�ȣ����γ���������Ҫ���ء������ɿ����еĻҳ������ᡢ���ᡢ�л�̼�⻯����������γɵ�������
��1�������е�SO2���̳��Ĵ����γ�����ķ�Ӧ����ʽ��____________________��
��2����֪2SO2 (g)+ O2 (g) 2SO3(g) ��H����196kJ/mol����߷�Ӧ��SO2��ת���ʣ��Ǽ���SO2�ŷŵ���Ч��ʩ��
2SO3(g) ��H����196kJ/mol����߷�Ӧ��SO2��ת���ʣ��Ǽ���SO2�ŷŵ���Ч��ʩ��
��T�¶�ʱ����2L�ݻ��̶�������ܱ������м���2.0 mol SO2��1.0 mol O2��5 min��Ӧ�ﵽƽ�⣬���������ת����Ϊ50%�����(O2)��____________��
���ڢٵ������£��жϸ÷�Ӧ�ﵽƽ��״̬�ı�־��_______(����ĸ)��
A��SO2 ��O2��SO3���ߵ�Ũ��֮��Ϊ2��1��2 B�������������ѹǿ����
C�������ڻ��������ܶȱ��ֲ��� D��SO3�����ʵ������ٱ仯
E��SO2 ���������ʺ�SO3�������������
������Ӧ��ʼʱ���������м���1.5 mol SO2��0.8 mol O2����ƽ�����������ת���� ������ת���ʣ�����ڡ�С�ڻ���ڣ���
��3�������е�SO2������NaOH��Һ���գ������õ�Na2SO3��Һ���е�⣬��ѭ������NaOH��ͬʱ�õ�H2SO4����ԭ������ͼ��ʾ�����缫����Ϊʯī��

��ͼ��a��Ҫ���ӵ�Դ�ģ������������_______����C��������������_______��
��SO32���ŵ�ĵ缫��ӦʽΪ_____________________________________��
�۵�������������12.6gNa2SO3�����������仯������Ϊ_______g(����ù���������Һ��������ܱ�)��
��1��2SO2+2H2O+O2=2H2SO4 ��2����0.05mol/(L��min) �� BDE �۴���
��3���ٸ� ���� �� SO32���C2e����H2O��SO42��+2H+ ��4.4
��������
�����������1�������е�SO2���̳��Ĵ����γ�����ķ�Ӧ����ʽ��2SO2+2H2O+O2=2H2SO4 ����2�����ڷ�Ӧ��ʼʱn(SO2) =2mol��5 min��Ӧ�ﵽƽ�⣬���������ת����Ϊ50%����Ӧ���ĵ�SO2�����ʵ���Ϊ1mol,��Ϊ�ڷ�ӦʱSO2 �� O2�ǰ���2:1���ĵģ����Է�Ӧ�����������ʵ���Ϊ0.5mol,��˦�(O2)��0.5mol��2L��5 min=0.05mol/(L��min)����A���ڷ�Ӧ��SO2 ��O2��SO3�ǰ���2:1:2�Ĺ�ϵ�仯�ģ����Ǵﵽƽ��ʱ���ǵĹ�ϵ���ܷ�������������Ҳ���ܲ����ϡ���˲�����Ϊƽ��ı�־������B�����ڸ÷�Ӧ�ķ�Ӧǰ������������ȣ����ﵽƽ�⣬�������������ʵ������䣬ѹǿҲ���䡣��������������ѹǿ���������Ϊ�ж�ƽ��ı�־����ȷ��C�������������ݻ����䣬��Ӧ�ַ��������غ㶨�ɣ��������۷�Ӧ���е�ʲô�̶ȣ������ڻ��������ܶȶ����ֲ��䣬�ʲ�����Ϊ�ж�ƽ��ı�־������D������Ӧ�ﵽƽ�⣬�κ�һ�����ʵ����ʵ��������䣬Ũ��Ҳ���䣬���SO3�����ʵ������ٱ仯������Ϊ�ж�ƽ��ı�־����ȷ��E��ÿ����1��SO2 �ͻ�ͬʱ����1��SO3�����ڵ�SO2�������ʺ�SO3������������ȣ���SO2�������ʺ�SO2������������ȣ���Ӧ�ﵽƽ�⡣��˿���Ϊ�ж�ƽ��ı�־ ����ȷ��������Ӧ��ʼʱ���������м���1.5 mol SO2��0.8 mol O2��n(SO2):n(O2)<2:1,���������˵����������ƽ�����������ת���ʴ���������ת���ʡ���3������ͼ������Na+��a�������ƶ�������ͬ�ֵ����ų⣬���ֵ���������ԭ��aҪ���ӵ�Դ�ĸ�����b���ӵ�Դ����������������SO32�����Ϸŵ��ΪSO42������˴�C�����������������ᡣ��SO32���ŵ�ĵ缫��ӦʽΪSO32���C2e����H2O��SO42��+2H+���۵�������������12.6gNa2SO3��n(Na2SO3)= 12.6g��126g/mol=0.1mol,�����ת��0.2mol,������������Ӧ��2H++2e-=H2��.�ų�����0.1mol,��������0.2g,ͬʱ���������0.2mold Na+,����Һ����4.6g,�ʸ����������������4.4g��
���㣺���黯ѧ��Ӧ���ʵļ��㡢ƽ��״̬���жϡ���ѧ����ʽ�����ӷ���ʽ����д���缫���жϼ��������� ��Һ�����ı仯�����֪ʶ��


 ����ʦ��Сһ����ʦ������ҵϵ�д�
����ʦ��Сһ����ʦ������ҵϵ�д� ���100�ֵ�Ԫ�Ż�������ϵ�д�
���100�ֵ�Ԫ�Ż�������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ��2013-2014ɽ��ʡ��һ��ѧ�����л�ѧ�Ծ��������棩 ���ͣ�ѡ����
�������ʵĵ���ʽ��д��ȷ���� �� ��
A��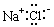 B��
B��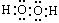 C��
C��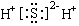 D��
D��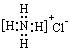
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2013-2014ɽ��ʡ6�¸߶���ѧ��ĩ���Ծ��������棩 ���ͣ�ѡ����
���и��������е�������һ��ʱ�����۰����ֱ�����ϣ����ȼ�պ�����ˮ������Ϊһ������������CO2����ҲΪһ��ֵ����
A.��ȩ���Ҵ����Ҷ��� B.�������ӡ�����ϩ
C.��Ȳ����������ϩ D.���顢���顢��ϩ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2013-2014ɽ������һ�С����ζ��С��ٷ�һ�С�������ѧ������ѧ�������棩 ���ͣ������
(15��)��1����֪�ڳ��³�ѹ�£�
�� 2CH3OH(l)+3O2(g) 2CO2(g)+4H2O(g) ��H= -1275.6 kJ��mol��1
�� H2O(l) H2O(g) ��H= + 44.0 kJ.mol��1
д����ʾ�״�ȼ���ȵ��Ȼ�ѧ����ʽ ��
��2���״���һ����Ҫ�Ļ���ԭ�ϣ�����һ�ֿ�������Դ�����п�����Ӧ�õĹ���ǰ����
����һ | CO(g) +2H2(g) |
������ | CO2(g) +3H2(g) |
��ҵ�Ͽ������·����ϳɼ״���
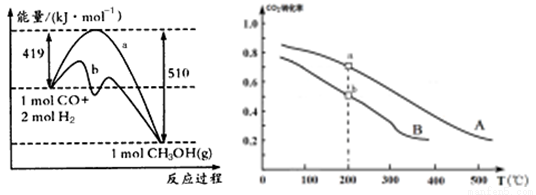
����һ ������
�ٷ���һ���÷�Ӧ�ġ�S 0���������������ͼ������a������b�Ĵ�ʩ��
�����º���ʱ������˵����˵����Ӧ����ƽ��״̬���� ��
A.��ϵ��ƽ��Ħ���������ٸı� B. V(CO)= V(CH3OH)
C. H2��ת���ʴﵽ������� D. ��H���ٸı�
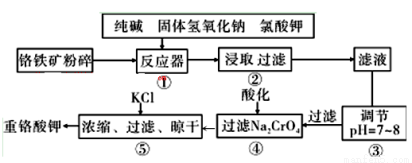
�ڷ���������CO2��H2�����ʵ���֮��1:3�������Ϊ2.0L�ĺ����ܱ������з�Ӧ����ͼ�������߷ֱ��ʾѹǿΪ0.1 MPa��5.0 MPa��CO2ת�������¶ȵı仯��ϵ������a���ƽ�ⳣ������ʽΪ�� ��a��b���㻯ѧ��Ӧ���ʱ���Va��Vb��ʾ����Va Vb������ڡ�����С�ڡ����ڡ����� ��֪ԭ��������=������������������������������֮�ȣ���һ��ԭ���������Ƿ�������ԭ�������ʵ� ��(������λС��).
��3���״���ˮ�ʻ����һ������Ⱦ����һ�ֵ绯ѧ��������������Ⱦ����ԭ����ͨ���Co2��������Co3����Ȼ����Co3������������ˮ�еļ״�������CO2��������д����ȥ�״������ӷ���ʽ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2013-2014ɽ������һ�С����ζ��С��ٷ�һ�С�������ѧ������ѧ�������棩 ���ͣ�ѡ����
NA��ʾ�����ӵ�����������˵����ȷ����
A��60��SiO2����2NA��Si��O���ۼ�
B��1.0 L 1.0 mo1/L��NaAlO2ˮ��Һ�к��е���ԭ����Ϊ2NA
C��8.2 g Na218O2��������CO2��H2O(g)�Ļ�������ַ�Ӧ��ת�Ƶ�����Ϊ0.1NA
D��NA��Fe(OH)3�������ӵ�����Ϊ107g
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2013-2014ɽ����ѧ���и����ڶ�ѧ��5�������ۺϻ�ѧ�Ծ��������棩 ���ͣ�ѡ����
��֪��3CH4(g) + 2N2(g) 3C(s) + 4NH3(g) ��H��0����700�棬CH4��N2�ڲ�ͬ���ʵ���֮��[n(CH4)/n(N2)]ʱCH4��ƽ��ת��������ͼ��ʾ��
3C(s) + 4NH3(g) ��H��0����700�棬CH4��N2�ڲ�ͬ���ʵ���֮��[n(CH4)/n(N2)]ʱCH4��ƽ��ת��������ͼ��ʾ��

����˵����ȷ����
A��n(CH4)/n(N2)Խ��CH4��ת����Խ��
B��n(CH4)/n(N2)����ʱ�������£�NH3���������������
C��b���Ӧ��ƽ�ⳣ����a��Ĵ�
D��a���Ӧ��NH3���������ԼΪ26%
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2013-2014ɽ��ʡ�ൺ�и����ڶ���ģ�⿼�����ۻ�ѧ�Ծ��������棩 ���ͣ�ʵ����
��12�֣�����ѧ������ѧ�뼼����
�ظ�����ǹ�ҵ������ʵ���ҵ���Ҫ����������ҵ�ϳ��ø�������Ҫ�ɷ�ΪFeO��Cr2O3������ΪSiO2��Al2O3��Ϊԭ��������ʵ����ģ�ҵ���ø�������K2Cr2O7����Ҫ��������ͼ���漰����Ҫ��Ӧ��: 6FeO��Cr2O3+24NaOH+7KClO3=12Na2CrO4+3Fe2O3+7KCl+12H2O
��1�����ǰ������������Ŀ���� ��
��2������۵���pH����˵õ��������� ��
��3���������У��ữʱ��CrO42-ת��ΪCr2O72-��д��ƽ��ת�������ӷ���ʽ ��
��4���ü�Ҫ������˵�������ݼ���KC1��ԭ��
��5��Ŀǰ��������Cr2O72-��ˮ������������巨���÷������ˮ�м���FeSO4 ��7H2O��Cr2O72-��ԭ��Cr3+������pH��Fe��Crת�����൱��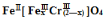 ����������,�������ֱ�ʾԪ�ؼ�̬���ij���������1mol Cr2O72-�������a mol FeSO4 ? 7H2O�����н�����ȷ����_______��
����������,�������ֱ�ʾԪ�ؼ�̬���ij���������1mol Cr2O72-�������a mol FeSO4 ? 7H2O�����н�����ȷ����_______��
A��x =0.5 ,a =8 B��x =0.5 ,a = 10 C��x = 1.5 ,a =8 D��x = 1.5 ,a = 10
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2013-2014ɽ��ʡ��̨�и���5����Ӧ�Բ���һ���ۻ�ѧ�Ծ��������棩 ���ͣ�ѡ����
25��ʱ������c(CH3COOH)+c(CH3COO-)=0��1mol��L-1�Ĵ���ʹ����ƻ����Һ�У�c(CH3COO-)��pH�Ĺ�ϵ��ͼ��ʾ�����������������
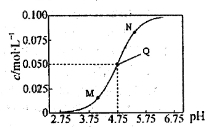
A�����¶��´���ĵ��볣��KaΪl0-4.75mol��L-l
B��M������ʾ����Һ�У� c(Na+)+c(H+)+c(CH3COOH)=0��1 mol��L-1
C��N������ʾ����Һ�У�c(CH3COO-)>c(CH3COOH)>c(H+)>c(OH-)
D��Q������ʾ����Һ�м���������0��05mol��L-1NaOH��Һ��ַ�Ӧ��pH>7
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2013-2014ɽ��ʡΫ������ѧ�����п��Ը�һ��ѧ�Ծ��������棩 ���ͣ������
��8�֣�ȡ100mL FeCl3��AlCl3�Ļ����Һ����μ������ʵ���Ũ��Ϊ1 mol��L��1 ��NaOH��Һ�����ɳ��������ʵ��������NaOH��Һ���������λΪmL����ϵ����ͼ��ʾ��
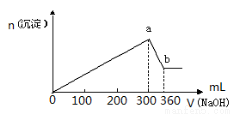
��Ҫ��ش�
��1��a���Ӧ���������ʵ����� mol����ʱ��Һ�е������� ��
��2��b���Ӧ���������ʵ����� mol��ԭ��Һ��c��AlCl3��= mol��L��1��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com