



科目:高中化学 来源: 题型:
| A、SO3+H2O=H2SO4 |
| B、Zn+2HCl=ZnCl2+H2↑ |
| C、Fe+CuSO4=FeSO4+Cu |
| D、KCl+AgNO3=KNO3+AgCl↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、滴定管装滴定液时应先用滴定液润洗 |
| B、锥形瓶用作反应容器时一定不能加热 |
| C、蒸馏时温度计水银球可以高于蒸馏瓶支管口 |
| D、振摇分液漏斗时只需要塞上其玻璃塞 |
查看答案和解析>>
科目:高中化学 来源: 题型:
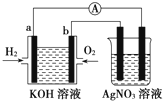 化学在能源开发与利用中起着十分关键的作用.氢气是一种新型的绿色能源,又是一种重要的化工原料.
化学在能源开发与利用中起着十分关键的作用.氢气是一种新型的绿色能源,又是一种重要的化工原料.
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、单质砹易溶于某些有机溶剂 |
| B、AgAt是不溶于水的有色固体 |
| C、HAtO4酸性比HClO4强 |
| D、HAt难溶于水,且受热很难分解 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、常温常压下,16 g O2含有NA个氧原子 |
| B、1mol苯含有3NA个碳碳单键和3NA个碳碳双键 |
| C、一定条件下,3molH2和1molN2充分反应后,可得到2NA个NH3分子数 |
| D、1 mol?L-1FeCl3溶液中含有Cl-总数为3NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com