
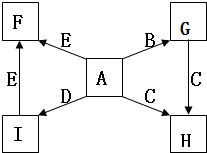
 如图,A、B、C、D、E是单质,G、H、I、F是B、C、D、E分别和A形成的二元化合物.已知:
如图,A、B、C、D、E是单质,G、H、I、F是B、C、D、E分别和A形成的二元化合物.已知:
| ||
| ||
| ||
| ||
| ||
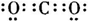 ;
;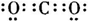 ;
;
| ||


 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案科目:高中化学 来源: 题型:
| A、1mol CH4的质量为16g |
| B、常温常压下,1mol任何气体的体积均为22.4L |
| C、H2SO4的摩尔质量为98g/mol |
| D、6.02×1023个SO2分子的质量为64g |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2mol的NaOH溶于1L水中形成的溶液 |
| B、2molNaOH溶于水配成1L的溶液 |
| C、每2升溶液中含有1mol NaOH |
| D、每2L溶液中含有2mol NaOH |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
+ 4 |
2- 3 |
2- 3 |
2- 4 |
- 2 |
- 3 |
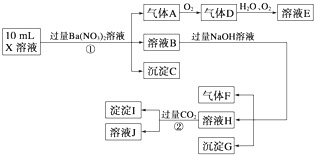
查看答案和解析>>
科目:高中化学 来源: 题型:
| 断裂或生成的化学键 | 能量数据 |
| 断裂1mol H2分子中的化学键 | 吸收能量436kJ |
| 断裂1mol Cl2分子中的化学键 | 吸收能量243kJ |
| 形成1mol HCl分子中的化学键 | 释放能量431kJ |
| A、氢气分子中的化学键比氯气分子中的化学键更牢固 |
| B、生成1 mol HCl时反应放热431 kJ |
| C、该反应的反应热△H>0 |
| D、相同条件下,氢气分子具有的能量高于氯气分子具有的能量 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com