
����Ŀ��������18��7�ĸ��ӣ���Ҫ������
A | He | ||||||||||||||||
G | C | D | |||||||||||||||
B | E | F | I | H | |||||||||||||
Fe | Cu | ||||||||||||||||
��1���÷�յ�ʵ���Ԫ�����ڱ���������ע�⣺����ʹ��Ǧ����ͼ��
��2��CԪ�ص�һ��������Ϊ10��ͬλ�ص�ԭ�ӷ���Ϊ �� C2�������ӽṹʾ��ͼΪ �� C��D��E��F�ļ����Ӱ뾶��С����˳���� �� ����д���ӷ��� ��
��3��A��G��C�е�2�ֻ�3��Ԫ�����γ�18�����ӵķ��������ѧʽ��������A��GҲ���γ�GA5�����ӻ������������ʽ����
��4����ֱ���1�����ӷ���ʽ˵��B��F�Ľ�����ǿ���� �� C��D�ķǽ�����ǿ�� ��
��5��Feλ�����ڱ������壬������ԭ���ԭ�����ʵ�飬��֤Cu2+��Fe3+�����Ե�ǿ����д���ܷ�Ӧʽ�������缫��Ӧʽ�� �� ���ڷ����ڻ���ʵ��װ��ͼ������ע�缫���Ϻ͵������Һ�� 
���𰸡�
��1��
��2��818O��![]() ��Al3+��Mg2+��F����O2��
��Al3+��Mg2+��F����O2��
��3��N2H4��H2O2��![]()
��4��Al3++3OH��=Al��OH��3����Al��OH��3+OH��=AlO2��+2H2O��2F2+2H2O=4HF+O2
��5�������ڣ�VIII�壻2 Fe3++Cu=2Fe2++Cu2+��Cu��2e��=Cu2+��
���������⣺����Ԫ�������ڱ��е�λ��֪��A��I�ֱ���H��Na��O��F��Mg��Al��N��Cl��SiԪ��.
��1.��Ԫ�����ڱ�������Ϊ  ��
��
���Դ��ǣ� 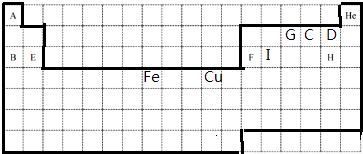 ��
��
��2.��C��OԪ�أ�CԪ�ص�һ��������Ϊ10��ͬλ�أ����Ԫ��ԭ��������Ϊ18����ԭ��Ϊ818O��
C2��������������8�������������10�������ӽṹʾ��ͼΪ ![]() �����Ӳ�ṹ��ͬ�����ӣ����Ӱ뾶����ԭ�������������С�������Ӱ뾶��С����˳����Al3+��Mg2+��F����O2�� �� ���Դ��ǣ�818O��
�����Ӳ�ṹ��ͬ�����ӣ����Ӱ뾶����ԭ�������������С�������Ӱ뾶��С����˳����Al3+��Mg2+��F����O2�� �� ���Դ��ǣ�818O�� ![]() ��Al3+��Mg2+��F����O2����
��Al3+��Mg2+��F����O2����
��3.��A��G��C�е�2�ֻ�3��Ԫ�����γ�18�����ӵķ�����H2O2��N2H4��
����A��GҲ���γ�GA5�����ӻ��������������笠����ӡ�������ΪH�� �� �û��������ʽΪ ![]() �����Դ��ǣ�N2H4��H2O2��
�����Դ��ǣ�N2H4��H2O2�� ![]() ��
��
��4.��Ԫ�صĽ�����Խǿ��������������ˮ�������Խǿ�����ӷ���ʽΪAl3++3OH��=Al��OH��3����Al��OH��3+OH��=AlO2��+2H2O��
Ԫ�صķǽ�����Խǿ���䵥�ʵ�������Խǿ���÷���ʽΪ2F2+2H2O=4HF+O2 ��
���Դ��ǣ�Al3++3OH��=Al��OH��3����Al��OH��3+OH��=AlO2��+2H2O��2F2+2H2O=4HF+O2��
��5.��Feλ�����ڱ��������ڵ�VIII�壬
���ԭ���ʵ�飬��֤Cu2+��Fe3+�����Ե�ǿ���������������Դ�ͭ���ӣ���Ӧ����ʽΪ2Fe3++Cu=2Fe2++Cu2+ �� ʧ���ӵĽ���Cu������������Cu���õĽ�����ķǽ�������������ʯī��������ӦʽΪCu��2e��=Cu2+ �� �����Ƶ�ԭ��غ������ţ���缫���������Ӧ�ĵ���ʾ�����ͬԪ�أ���Ƶ�ԭ���Ϊ  ��
��
���Դ��ǣ������ڣ�VIII�壻2 Fe3++Cu=2Fe2++Cu2+��Cu��2e��=Cu2+��  ��
��


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ͼ�к�����Ϊ���뷴Ӧ������ʵ�����������Ϊ�������������ʵ��������з�Ӧ��Ӧ��������ȷ����

A. A���߱�ʾ��AlCl3��Һ�е���NaOH��Һ������
B. B���߱�ʾ��Na[Al(OH)4]��Һ�е���HNO3��Һ������
C. C���߱�ʾ��n(HCl):n(AlC13)=1:1�Ļ����Һ�е���NaOH��Һ������
D. D���߱�ʾ��n[Ca(OH)2]:n(KOH)=1:2�Ļ����Һ��ͨ��CO2��������ʧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ӱ������Ӽ�������������ʾ����������Һ��������ʾͼ������֡��й�����ʾԭ����������ȷ���ǣ� ��
A.ʩ�ӵ�ѹʱ��Һ�����Ӵ�ֱ�ڵ糡��������
B.��ȥ�糡��Һ�����ӻָ���ԭ��״̬
C.ʩ�ӵ�ѹʱ��Һ�������ص糡��������
D.��ȥ�糡��Һ�����Ӵ�ֱ��ԭ�糡��������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������þ��Mg3N2���ڹ�ҵ�Ͼ��зdz��㷺��Ӧ�á�ij��ѧ��ȤС����þ�뵪����Ӧ�Ʊ�Mg3N2�������й�ʵ�顣ʵ��װ��������ʾ��

��֪���ٵ���þ������Ϊdz��ɫ��ĩ��������ˮ��Ӧ��
���������ƺ��Ȼ����ȡ�����ķ�Ӧ���ҷ��ȣ������������ٶȽϿ졣
���¶Ƚϸ�ʱ���������ƻ�ֽ����O2�ȡ�
�ش��������⣺
��1������b��������________��д��װ��A�з�����Ӧ�Ļ�ѧ����ʽ___________________��
��2��ijͬѧ����װ��A���ֵ������ԣ��ر�ֹˮ��c��������a��ˮ�������µΣ�ֱ��ȫ��������ƿ�����жϣ�A����װ���Ƿ�©����________���©����������©��������ȷ���������ж����ɣ�____________��
��3��װ��C��Ϊ��������������Һ��������___________��Fװ�õ�������_______________________��
��4����������Ӧ��ʼ������������A���ƾ��ƣ�ԭ����_______________________________________��
��5����Ӧ������ȡm g E����Ʒ���Թ��У�����������ˮ����V mL���壨����Ϊ��״����������Ʒ�е���þ����������Ϊ__________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��HArF�ǵ�һ�������ֵ�벻��������ӵı���ģ����ͼ��ʾ����HArF�з�Ϊ��1�ۣ��Ϊ0�ۣ���ˮ��Һ��ǿ���ԣ������������൱�������й�˵��������ǣ� �� 
A.ϡ��������һ��������Ҳ�ɷ�����ѧ��Ӧ
B.HAlFΪ���Է���
C.ArF�����н�ǿ��������
D.��HArF��Һ�м���NaOH����Ӧ�����ӷ���ʽΪ��H++OH���TH2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ǧ���仯������������ء������豸��X���߷������ϵȣ��ش��������⣺
��1��Ǧ��̼��ͬ��Ԫ�أ�������˵����ȷ���� ��
a����Ҫ���ϼ�Ϊ+2��+4
b��ͬ���Si��Ge���ࣩ��Ϊ�뵼����ϣ�ǦҲΪ�뵼����ϣ�
c��Ǧ������������Ӧˮ���������ǿ��̼��
d����ͬ���Ge���ࣩ���Ƚϣ�����Ge��OH��4��Pb��OH��4 �� �������Ge��Pb�����ڱ���λ��Pb��Ge���森
e��ͬ���Ge���ࣩ�������Ӧ��Pb�������ܷ�Ӧ����ԭ�Ӱ뾶Ge��Pb
��2��PbO2����PbO�����������Һ��Ӧ�Ƶã���Ӧ�����ӷ���ʽΪ ��
��3����Ŧ�Ʒ�����Ǧ������ط�Ӧ���Ȼ�ѧ����ʽ���£�
2PbS��s��+3O2��g��=2PbO��s��+2SO2��g����H=a kJmol��1
PbS��s��+2PbO��s��=3Pb��s��+SO2��g����H=b kJmol��1
PbS��s��+PbSO4��s��=2Pb��s��+2SO2��g����H=c kJmol��1
��Ӧ3PbS��s��+6O2��g��=3PbSO4��s����H=kJmol��1���ú�a��b��c�Ĵ���ʽ��ʾ����
��4�������������������Ĺ�����Դͨ��Ca/PbSO4�ȵ�أ���װ����ͼ1��ʾ���õ�������ĵ缫��ӦʽΪ �� 
��5��PbO2�ڼ��ȹ��̷����ֽ��ʧ��������ͼ2��ʾ����֪ʧ�������ϵ�a��Ϊ��Ʒʧ��4.0%[������ ![]() ��100%]�IJ������壮��a�������ɱ�ʾΪPbOx��mPbO2nPbO����ʽ����xֵ �� ��m��nֵ ��
��100%]�IJ������壮��a�������ɱ�ʾΪPbOx��mPbO2nPbO����ʽ����xֵ �� ��m��nֵ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��![]() �Ǻϳɸ߾۷�����ԭ�ϣ���ϳ�·�ߣ����ַ�Ӧ������ȥ��������ʾ��
�Ǻϳɸ߾۷�����ԭ�ϣ���ϳ�·�ߣ����ַ�Ӧ������ȥ��������ʾ��

��֪����.CH3CH==CH2![]() CH3CHO+HCHO��
CH3CHO+HCHO��
��. RCHO![]()
![]()
![]()
![]()
��1��A������Ϊ__________________��B���еĹ�������____________________��
��2���ڵķ�Ӧ������_________________________��
��3���ٵķ�Ӧ�Ļ�ѧ����ʽΪ___________________________________________��
��4���۵ķ�Ӧ�Ļ�ѧ����ʽΪ_________________________________________��
��5��D�Ľṹ��ʽΪ____����D��Ϊͬ���칹���Һ���̼̼˫����-COO-�ı��Ķ�ȡ������___�֣����к˴Ź�������Ϊ5��壬�ҷ������Ϊ2:1:2:2:1�Ľṹ��ʽΪ___________����дһ�֣���
��6��д����C2H5OHΪԭ�Ϻϳ����ᣨ![]() ����·�ߣ������Լ���ѡ���ϳ�·�߳��õı�ʾ��ʽΪ��
����·�ߣ������Լ���ѡ���ϳ�·�߳��õı�ʾ��ʽΪ��![]() ����_______________________��
����_______________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������ǹ����������ز�֮һ����ο�ͼ�е��й���Ϣ�ش��������⡣

��1�������������Ҫԭ���ǻƶ����ƶ��������������Ӫ��������Ҫ��_______�����������õ��˼ӵ��Σ�����ʳ���м���_______��д���⻯��������ƻ�ѧʽ����
��2�����������ƹ����л�������ְ����ᣬ��ζ����������Щ�������ͨʽΪ________��������õ�������Ϊ��ʳ��ԭ�����ڸ���������_______��Ӫ���ؽ��٣�������Ӫ���������������������������Ҫ��Դ���ʡ�
��3��ʢװ������չ�����_______����������л������ǽ���������Ʒ���չ���Ҫ�ɷ�Ϊ_______���Ρ�
��4�����װֽ������ֽ����Ҫ�ɷ���____________����װ����������Ҫ�ɷ��Ǿ۱�ϩ���ϣ��ɱ�ϩ�ϳɾ۱�ϩ�Ļ�ѧ����ʽΪ��_____________________________��
��5���۱�ϩ�Ȳ����Ƴɵ�������Ʒ��Ӧ���ⶪ������������׳ơ�_________��Ⱦ���Ļ������⡣
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʳƷ�㾫������������·�ߣ���Ӧ������ȥ�����£�
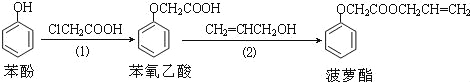
��������������ǣ� ��
A�����裨1�������в����ı��ӿ���FeCl3��Һ����
B�����ӺͲ���������������KMnO4��Һ������Ӧ
C����������Ͳ�����������NaOH��Һ������Ӧ
D�����裨2�������в����ı�ϩ��������ˮ����
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com