
| A. | 简单离子半径:W>Y>Z | |
| B. | 最高价氧化物对应水化物的酸性:Y<Z | |
| C. | 工业上制备W单质的方法为热还原法 | |
| D. | X分别与Y、Z形成的简单化合物所含化学键类型相同 |
分析 短周期主族元素X,Y,Z,W的原子序数依次增大,X,Y的原子序数之和等于Z的原子序数;Y,Z为同周期相邻元素,则X的原子序数为1,为H元素;X,W,Y分别排列在三个连续的奇数族,则W位于ⅢA族、Y为ⅤA族,结合X,Y,Z,W的原子序数依次增大可知W位于第三周期,为Al元素,Y位于第二周期,为N元素;X,Y的原子序数之和等于Z的原子序数,则Z的原子序数=1+7=8,为O元素,以此来解答.
解答 解:由上述分析可知,X、Y、Z、W分别为H、N、O、Al元素,
A.离子的电子层越多,离子半径越大,电子层相同时,离子的核电荷数越大,离子半径越小,则离子半径:Y>Z>W,故A正确;
B.Y、Z分别为N、O元素,O元素没有最高价含氧酸,故B错误;
C.W的单质为金属Al,为活泼金属,通过电解熔融氧化铝制取金属铝,不利用还原法,故C错误;
D.X(H)分别与Y(N)、Z(O)形成的最简单化合物分别为水、氨气,均含极性共价键,故D正确;
故选D.
点评 本题考查原子结构与元素周期律,为高频考点,把握元素的位置、原子序数关系来推断元素为解答的关键,侧重分析与应用能力的考查,注意规律性知识的应用,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
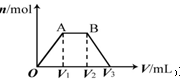 有KOH和Ca(OH)2的混合溶液,C(OH-)═0.1mol•L-1.取此溶液500mL,向其中通入CO2,通入CO2的体积(V)和生成沉淀的物质的量(n)的关系如图所示.图中(V1)为112mL(标准状况),则图中V2、V3的体积(单位为mL)分别是( )
有KOH和Ca(OH)2的混合溶液,C(OH-)═0.1mol•L-1.取此溶液500mL,向其中通入CO2,通入CO2的体积(V)和生成沉淀的物质的量(n)的关系如图所示.图中(V1)为112mL(标准状况),则图中V2、V3的体积(单位为mL)分别是( )| A. | 560、672 | B. | 1008、1120 | C. | 2240、2352 | D. | 392、504 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | A3BC4 | B. | A2BC4 | C. | A2BC3 | D. | A4BC4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 鉴别苯与四氯化碳:碘水 | |
| B. | 鉴别甲烷与乙烯:酸性高锰酸钾溶液 | |
| C. | 鉴别 与CH≡CH:溴水 与CH≡CH:溴水 | |
| D. | 鉴别NaCl与CH3CH2Cl:硝酸银溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
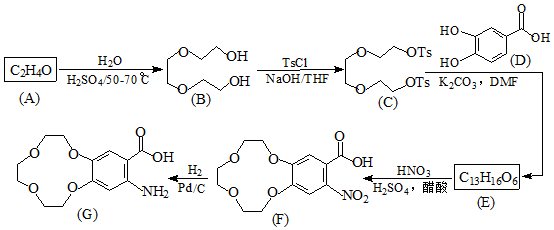
 .
. .
. .
.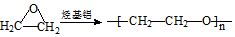 .
.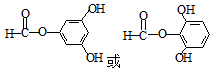 .
.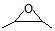 )和邻二苯酚为原料(其它试剂任选),设计制备
)和邻二苯酚为原料(其它试剂任选),设计制备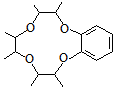 的合成路线.
的合成路线.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
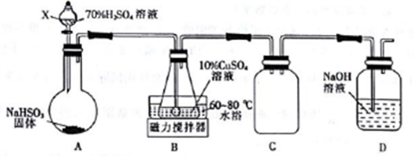
| 实验操作 | 预期现象及结论 |
| 取上述反应后的混合溶液于试管 A中,滴加稀硫酸 | 若有气泡产生,则①II(填“I”“II”或“III”,下同)成立,若没有气泡产生,则②I或III成立 |
| 另取上述反应后的混合溶液于试管B中,滴加几滴淀粉KI溶液,充分振荡 | ③溶液变为蓝色,则III成立 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 常温下,在10mL 0.1mol•L-1Na2CO3溶液中逐滴加入0.1mol•L-1HCl溶液,溶液的pH逐渐降低,此时溶液中含碳微粒的物质的量分数变化如图所示(CO2因逸出未画出,忽略因气体逸出引起的溶液体积变化),下列说法正确的是( )
常温下,在10mL 0.1mol•L-1Na2CO3溶液中逐滴加入0.1mol•L-1HCl溶液,溶液的pH逐渐降低,此时溶液中含碳微粒的物质的量分数变化如图所示(CO2因逸出未画出,忽略因气体逸出引起的溶液体积变化),下列说法正确的是( )| A. | 在0.1 mol•L-1Na2CO3溶液中:c(Na+)+c(H+)=c(CO32-)+c(HCO3-)+c(OH-) | |
| B. | 当溶液的pH为7时,溶液的总体积为20 mL | |
| C. | 在B点所示的溶液中,离子浓度最大的是HCO3- | |
| D. | 在A点所示的溶液中:c(CO32-)=c(HCO3-)>c(OH-)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验操作和现象 | 实验结论 | |
| A | 检验某溶液中是否含有SO42-时,向溶液中滴加用盐 酸酸化的BaCl2溶液,有白色沉淀生成 | 该溶液中一定含有SO42- |
| B | 检验输送氯气的管道是否发生泄漏时,用一根玻璃棒蘸取浓氨水,然后靠近管道 | 有白色烟雾产生时说明管道发生泄漏 |
| C | 检验FeCl3溶液中是否含有Fe2+时,向溶液中滴加 酸性KMnO4溶液,溶液变为无色 | 该溶液中一定含有Fe2+ |
| D | 向2mL0.1mol•L-1 硝酸银溶液中加入几滴0.1mol•L-1NaCl溶液,出现白色沉淀,再加入几滴0.1mol•L-1Na2S溶液,有黑色沉淀生成 | 该现象说明相同温度下Ksp(Ag2S)<Ksp(AgCl) |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 1 mol阿司匹林最多可消耗5 molH2 | |
| B. | 水杨酸分子中所有原子可能共面 | |
| C. | 水杨酸可以发生取代、加成、氧化、加聚反应 | |
| D. | 1 mol阿司匹林最多可消耗2 molNaOH |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com