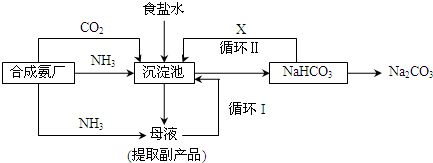
工业上制备BaCl
2的工艺流程图如下,某研究小组在实验室用重晶石(主要成分为BaSO
4)对上述工业过程进行了模拟实验.
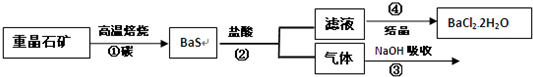
(1)步骤①中BaSO
4与碳在高温下反应,每1mol碳生成CO需要吸收142.8kJ的热量,此反应的热化学方程式为
.
(2)向BaCl2溶液中加入AgNO3和KBr,当两种沉淀共存时,
=
.
【已知:Ksp(AgBr)=5.4×10-13,Ksp(AgCl)=2.0×10-10】
(3)在实验室中BaCl2的重要用途之一是检验SO
42-,要检验某无色溶液中含有SO
42- 的操作方法是:取少量样品,先加入足量的
(填试剂名称),无明显现象,再滴加少量
(填试剂名称),若有白色沉淀产生,说明含有SO
42-.
(4)将SO
2通入BaCl
2溶液至饱和,未见有沉淀,继续通入另一种气体有沉淀生成,则后通入的气体不可能是
.
A.NH
3 B.NO
2 C.CO
2 D.H
2S
(5)若NaOH溶液吸收H
2S气体生成等物质的量的Na
2S和NaHS,则溶液中阴离子浓度由大到小的顺序为
.
(6)将pH=1的稀硫酸慢慢加入一定量的BaCl
2的溶液中,恰好使Ba
2+沉淀完全,此时混合溶液的体积为100mL,且混合溶液的pH=2,则原BaCl
2溶液中Cl
-的浓度为
mol/L.(保留小数点后三位)




 阅读快车系列答案
阅读快车系列答案