
| A. | Z可以电离 | B. | Z可以表示为:XY2 | C. | X形成+2价阳离子 | D. | Z的电子式为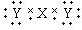 |
分析 元素X的一个原子失去2个电子并转移到元素Y的两个原子上,形成化合物Z,该反应是通过得失电子形成的化合物,所以Z为离子化合物,根据原子守恒确定Z的化学式为XY2,以此解答该题.
解答 解:元素X的一个原子失去2个电子并转移到元素Y的两个原子上,形成化合物Z,该反应是通过得失电子形成的化合物,所以Z为离子化合物,根据原子守恒确定Z的化学式为XY2,
A.Z为离子化合物,则Z可以电离,故A正确;
B.元素X的一个原子失去2个电子并转移到元素Y的两个原子上,形成化合物Z,根据原子守恒确定Z的化学式为XY2,故B正确;
C.元素X的一个原子失去2个电子,则X形成+2价阳离子,故C正确;
D.Z为离子化合物,其电子式为: ,故D错误.
,故D错误.
故选D.
点评 本题考查了原子结构和元素的性质,根据得失电子确定化学键类型,再结合原子结构、物质构成分析解答,题目难度不大.


科目:高中化学 来源: 题型:解答题
| 离 子 | K+ | Na+ | NH4+ | SO42- | NO3- | Cl- |
| 浓度/mol•L-1 | 4×10-6 | 6×10-6 | 2×10-5 | 4×10-5 | 3×10-5 | 2×10-5 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常用铝盐溶液与氨水反应制取氢氧化铝 | |
| B. | 澄清石灰水盛装在用玻璃塞塞紧的试剂瓶中 | |
| C. | 氢气在氯气中燃烧产生苍白色火焰 | |
| D. | 新制氯水通常保存在棕色试剂瓶 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ③④ | B. | ①②⑤ | C. | ②⑤ | D. | ③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X的能量不一定高于M的能量 | |
| B. | X和Y的总能量一定低于M和N的总能量 | |
| C. | 破坏反应物中的化学键所吸收的能量小于形成生成物中化学键所放出的能量 | |
| D. | 此反应符合质量守恒,却不符合能量守恒 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③④ | B. | ①②④ | C. | ①④ | D. | ②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaHCO3溶液与盐酸:CO32-+2 H+=H2O+CO2↑ | |
| B. | 硝酸银溶液与铜:Cu+Ag+=Cu2++Ag | |
| C. | 金属钾与水反应:K+H2O═K++OH-+H2↑ | |
| D. | 用醋酸除水垢:2CH3COOH+CaCO3=Ca2++2CH3COO-+H2O+CO2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
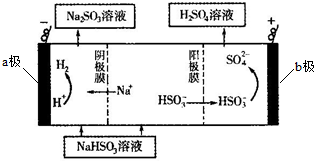
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
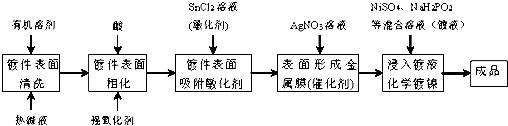
| 反应时间t/s | 1 | 4 | 9 | 16 |
| 镀层厚度y/nm | a | 2a | 3a | 4a |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com