
| A. | Na、Mg、Al还原性依次减弱 | B. | I2、Br2、Cl2氧化性依次增强 | ||
| C. | C、N、O原子半径依次增大 | D. | P、S、Cl最高正价依次升高 |
分析 A.同周期从左向右金属性减弱,还原性减弱;
B.同主族从上到下非金属性减弱;
C.同周期从左向右原子半径减小;
D.第三周期元素的最高正价从左向右增大.
解答 解:A.同周期从左向右金属性减弱,还原性减弱,则Na、Mg、Al还原性依次减弱,故A正确;
B.同主族从上到下非金属性减弱,对应单质的氧化性减弱,则I2、Br2、Cl2氧化性依次增强,故B正确;
C.同周期从左向右原子半径减小,则C、N、O原子半径依次减小,故C错误;
D.第三周期元素的最高正价从左向右增大,则P、S、Cl最高正价依次升高,故D正确;
故选C.
点评 本题考查周期表和周期律的综合应用,为高频考点,把握元素的位置、元素的性质、元素周期律等为解答的关键,侧重分析与应用能力的考查,注意规律性知识的应用,题目难度不大.


 小学期末冲刺100分系列答案
小学期末冲刺100分系列答案 期末复习检测系列答案
期末复习检测系列答案 超能学典单元期中期末专题冲刺100分系列答案
超能学典单元期中期末专题冲刺100分系列答案 黄冈360度定制密卷系列答案
黄冈360度定制密卷系列答案科目:高中化学 来源: 题型:选择题
| A. |  装置中阳极上析出红色固体 | B. | 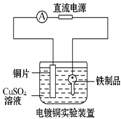 装置中铜片应与电源负极相连 | ||
| C. |  装置中外电路电流方向:b极→a极 | D. |  装中阴极反应:2Cl--2e-═Cl2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 同周期元素的原子半径以ⅤⅡA族的为最大 | |
| B. | 同主族元素两种元素原子的核外电子数的差值可能为26 | |
| C. | 短周期元素中次外层电子数是最外层电子数2倍的原子一定是非金属元素 | |
| D. | 同周期第ⅡA族和ⅢA族元素的原子序数之差不可能为25 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
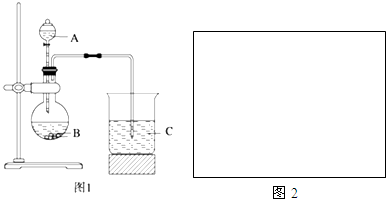
 某化学兴趣小组选用如图实验装置,测定某工业尾气(含SO2、N2、O2)中SO2的含量.
某化学兴趣小组选用如图实验装置,测定某工业尾气(含SO2、N2、O2)中SO2的含量.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 根据反应Cu+H2SO4$\frac{\underline{\;电解\;}}{\;}$CuSO4+H2↑可推出Cu的还原性比H2的强 | |
| B. | 在反应CaH2+2H2O═Ca(OH)2+2H2↑中,水作氧化剂 | |
| C. | 反应3NO2+H2O═2HNO3+NO中氧化剂和还原剂的物质的量之比是3:1 | |
| D. | 因Cl2的氧化性强于I2的氧化性,所以置换反应I2+2NaClO3═2NaIO3+Cl2不能发生 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 7.2g CaO2晶体中阴离子和阳离子总数为0.3NA | |
| B. | 反应3H2(g)+N2(g)?2NH3(g)△H=-92 kJ/mol放出热量9.2kJ时,转移电子0.6NA | |
| C. | 0.1 mol/L NH4Cl溶液中Cl-离子数目为0.1NA | |
| D. | 0.1 mol H2O2分子中含极性共价键数目为0.3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | A-x-n | B. | A-x+n | C. | A+x-n | D. | A+x+n |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com