
(1)肼(N2H4)是火箭发动机的燃料,它与N2O4反应时,N2O4为氧化剂,生成氮气和水蒸气。 已知:N2(g)+2O2(g)===N2O4(g) ΔH=+8.7 kJ/mol,
N2H4(g)+O2(g)===N2(g)+2H2O(g)ΔH=-534.0 kJ/mol,
则表示肼跟N2O4反应的热化学方程式
(2)用CO2和氢气合成CH3OCH3(甲醚)是解决能源危机的研究方向之一。
已知:CO(g)+2H2(g)  CH3OH(g) ΔH=-90.7 kJ·mol-1
CH3OH(g) ΔH=-90.7 kJ·mol-1
2CH3OH(g)  CH3OCH3(g)+H2O(g) ΔH=-23.5 kJ·mol-1
CH3OCH3(g)+H2O(g) ΔH=-23.5 kJ·mol-1
CO(g)+H2O(g)  CO2(g)+H2(g) ΔH=-41.2 kJ·mol-1
CO2(g)+H2(g) ΔH=-41.2 kJ·mol-1
则CO2和氢气合成CH3OCH3(g)的热化学方程式为
______________________________________________________________________。
科目:高中化学 来源: 题型:
钾(K)与钠(Na)在性质上具有很大的相似性,但K比Na的活泼性强,下面是根据Na的性质对K的性质的预测,其中正确的是( )。
A.K的活泼性强,所以钾应该保存在煤油中
B.K可被空气中的氧气氧化,且氧化产物在常温和加热条件下均为K2O
C.K与水能够反应,但不如Na与水的反应剧烈,但产物都有氢气
D.K可以与水剧烈反应,生成氢气
查看答案和解析>>
科目:高中化学 来源: 题型:
用Na2SO3溶液吸收硫酸工业尾气中的二氧化硫,将所得的混合液进行电解循环再生,这种新工艺叫再生循环脱硫法。其中阴、阳离子交换膜组合循环再生机理如下图所示,则下列有关说法中不正确的是( )

A.X为直流电源的负极,Y为直流电源的正极
B.阳极区pH增大
C.图中的b>a
D.该过程中的产品主要为H2SO4和H2
查看答案和解析>>
科目:高中化学 来源: 题型:
25 ℃、101 kPa下,碳、氢气、甲烷和葡萄糖的燃烧热依次是393.5 kJ·mol-1、285.8 kJ·mol-1、890.3 kJ·mol-1、2 800 kJ·mol-1,则下列热化学方程式正确的是 ( )
A.C(s)+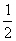 O2(g)====CO(g);ΔH=-393.5 kJ·mol-1
O2(g)====CO(g);ΔH=-393.5 kJ·mol-1
B.2H2(g)+O2(g)====2H2O(g);ΔH=+571.6 kJ·mol-1
C.CH4(g)+2O2(g)====CO2(g)+2H2O(g);ΔH=-890.3 kJ·mol-1
D.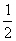 C6H12O6(s)+3O2(g)====3CO2(g)+3H2O(l);ΔH=-1 400 kJ·mol-1
C6H12O6(s)+3O2(g)====3CO2(g)+3H2O(l);ΔH=-1 400 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
25 ℃,101 k Pa时,强酸与强碱的稀溶液发生中和反应生成1mol水时所放出的热量约为57.3 kJ/mol;辛烷的燃烧热为5518 kJ/mol。下列热化学方程式书写正确的是( )
A.CH3COOH(aq)+NaOH(aq)=== CH3COONa(aq)+H2O(l)  H=
H= 57.3kJ/mol
57.3kJ/mol
B.KOH(aq)+ H
H SO4(aq)=
SO4(aq)=  K2SO4(aq)+H2O(l)
K2SO4(aq)+H2O(l)  H=
H= 57.3kJ/mol
57.3kJ/mol
C.C8H18(l)+  O2 (g)=8CO2 (g)+ 9H2O(g)
O2 (g)=8CO2 (g)+ 9H2O(g)  H=
H= 5518 kJ/mol
5518 kJ/mol
D.2C8H18(l)+25O2 (g)=16CO2 (g)+18H2O(1)  H=
H= 11036 kJ/mol
11036 kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述正确的是
A、浓氨水中滴加FeCl3饱和溶液可制得Fe(OH)3胶体
B、CH3COONa溶液中滴加少量浓盐酸后c(CH3COO-)增大
C、Ca(HCO3)2溶液与过量NaOH溶液反应可制得Ca(OH)2
D、25℃时Cu(OH)2在水中的溶解度大于其在Cu(NO3)2溶液中的溶解度
查看答案和解析>>
科目:高中化学 来源: 题型:
对于H-+H2O===H2+OH-说法正确的是
A、该反应属于置换反应 B、若该反应中有1 mol电子转移,则生成H2是22.4 L
C、水是氧化剂 D、H2只是氧化产物
查看答案和解析>>
科目:高中化学 来源: 题型:
按如图所示装置进行铁和水蒸气反应的实验。

(1)铁粉与水蒸气反应的化学方程式是: ;
(2)为检验生成的气体产物,需从下图选择必要的装置,其正确的连接顺序为(用接口字母表示)a— ,描述能证明气体产物的实验现象_ ;

(3)停止反应,待装置冷却后,取出反应过的铁粉混合物,加入过量的稀硫酸充分反应。过滤。简述检验所得滤液中Fe3+的操作方法: ;
(4)经检验上述滤液中不含Fe3+,这不能说明铁粉与水蒸气反应所得产物中不含+3价的铁。原因是(用化学方程式说明): ;
(5)某同学利用上述滤液制取白色的Fe(OH)2沉淀,向滤液中加入NaOH溶液后,观察到生成的白色沉淀迅速变成灰绿色,最后变成红褐色。
①沉淀由白色变为红褐色的化学方程式是: ;
②为了得到白色的Fe(OH)2沉淀,并尽可能使沉淀长时间保持白色,有同学设计如下图所示的装置: 通电后,溶液中产生大量的白色沉淀,且较长时间不变色。下列说法中正确的是________(填序号)。
通电后,溶液中产生大量的白色沉淀,且较长时间不变色。下列说法中正确的是________(填序号)。
A.电源中的a为正极,b为负极 B.可以用NaCl溶液作为电解液
C.A、B两端都必须用铁作电极 D.阴极发生的反应是2H++2e-===H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
一定条件下,可逆反应N2 +3H2 2NH3(正反应为放热反应)达到平衡,当单独改变下述条件后,有关叙述错误的是( )
2NH3(正反应为放热反应)达到平衡,当单独改变下述条件后,有关叙述错误的是( )
A、加催化剂,V正、V逆 都发生变化,且变化的倍数相等
B、加压,V正、V逆 都增大,且V正 增大的倍数大于V逆 增大的倍数
C、降温,V正、V逆 都减小,且V正 减小的倍数大于V逆 减小的倍数
D、增大氮气的浓度,V正、V逆 都增大,且V正 增大倍数大于V逆 增大倍数;N2 转化率减小,H2转化率增大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com