
 将Mg和Al粉末均匀混合,加入到100mL某浓度的硫酸中,产生氢气的体积(标准状况下)与加入粉末的质量关系如图所示:
将Mg和Al粉末均匀混合,加入到100mL某浓度的硫酸中,产生氢气的体积(标准状况下)与加入粉末的质量关系如图所示:| n |
| c |
| 350mL |
| 100mL |
| 11.2L |
| 22.4L/mol |
| 0.5mol |
| 0.1L |
| 1mol |
| 5mol/L |
| 350mL |
| 100mL |
| 33.3g |
| 11.1g |
|


科目:高中化学 来源: 题型:
| A、当a=2,b=1时,离子方程式为:2Fe2++Br2→2Fe3++2Br- | ||||
B、如果反应后的溶液中存在c(Fe2+)=c(Fe3+),则
| ||||
| C、当a=1,b=2时,离子方程式为:2Fe2++4I-+3Br2→2Fe3++2I2+6Br- | ||||
| D、当a=2,2<b<3时,溶液中铁元素以两种离子形式存在,且一定是c(Fe3+)>c(Fe2+) |
查看答案和解析>>
科目:高中化学 来源: 题型:
 19世纪丹麦学者尤利乌斯?托姆森得到一个计算CuCl2?2H2O在水中溶解热效应(设为△H,且当△H<0,放热;△H>0吸热)的式子,当所得溶液中1mol CuCl2有x mol水时,所产生的热效应△H=[3.35-21.02×
19世纪丹麦学者尤利乌斯?托姆森得到一个计算CuCl2?2H2O在水中溶解热效应(设为△H,且当△H<0,放热;△H>0吸热)的式子,当所得溶液中1mol CuCl2有x mol水时,所产生的热效应△H=[3.35-21.02×| (x-10) |
| x+11.24 |
| A、仅根据题中信息,无法计算出20℃时CuCl2饱和溶液的物质的量浓度 |
| B、当x<10,因CuCl2不能完全溶解,上图无物理意义 |
| C、在极稀的溶液中,1 mol CuCl2溶液时约放出17.67kJ热量 |
| D、CuCl2?2H2O溶于水是放热的 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 工业上生产硫酸时,利用催化氧化反应将SO2转化为SO3是一个关键步骤.
工业上生产硫酸时,利用催化氧化反应将SO2转化为SO3是一个关键步骤.| 1 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 利用氮气、氢气在一定条件下生成氨气这一可逆反应来合成氨,是一个重要的化工反应.常用来生产液氨和氨水.完成下列填空:
利用氮气、氢气在一定条件下生成氨气这一可逆反应来合成氨,是一个重要的化工反应.常用来生产液氨和氨水.完成下列填空:查看答案和解析>>
科目:高中化学 来源: 题型:
 有如下化学反应:2A(g)+B(g)??2C(g)(正反应为放热反应).
有如下化学反应:2A(g)+B(g)??2C(g)(正反应为放热反应).查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
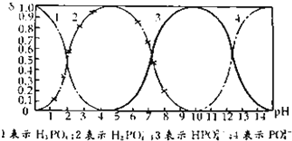 磷酸(H3PO4)在溶液中能够以H3PO4、H2PO4-、HPO42-和PO43-四种粒子的形式存在,当溶液中的pH发生变化时,其中任一种粒子的物质的量占四种粒子总物质的量的分数δ也可能发生变化.如图所示是H3PO4溶液中,各种粒子的物质的量分数δ随pH变化曲线:
磷酸(H3PO4)在溶液中能够以H3PO4、H2PO4-、HPO42-和PO43-四种粒子的形式存在,当溶液中的pH发生变化时,其中任一种粒子的物质的量占四种粒子总物质的量的分数δ也可能发生变化.如图所示是H3PO4溶液中,各种粒子的物质的量分数δ随pH变化曲线:| c(Na+) |
| c(PO43-) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com