
分析 根据诗句提供的信息,千锤百凿出深山属于物理变化,烈火焚烧若等闲是指高温煅烧石灰石,粉身碎骨浑不怕是指将生石灰与水反应,要留清白在人间是指氢氧化钙与二氧化碳的反应,据此进行分析解答即可.
(1)酸由氢离子和酸根离子构成,碱是电离出的阴离子全部是氢氧根离子的化合物,电离生成金属阳离子(或铵根离子)和含氧酸根离子的化合物属于含氧酸盐,电离生成金属阳离子(或铵根离子)和无氧酸根离子的化合物属于无氧酸盐,电离生成金属阳离子(或铵根离子)和碳酸根离子的化合物属于无氧酸盐;
(2)“烈火焚烧若等闲”是指高温煅烧石灰石,碳酸钙分解生成二氧化碳和氧化钙,二氧化碳为温室效应气体;
(3)化合反应是指由两种或两种以上物质反应生成另外一种物质的反应;由一种反应物生成两种或两种以上其他物质的反应叫分解反应;
(4)发生的反应中元素的化合价变化,则发生氧化还原反应,反之不发生氧化还原反应;
(5)摩尔质量在数值上等于其相对分子质量,单位为g/mol,根据n=$\frac{m}{M}$计算物质的量结合化学式计算50g该物质中原子的总数.
解答 解:(1)千锤百凿出深山,是开采石灰石,主要成分化学式为:CaCO3,由金属阳离子(钙离子)和含氧酸根离子(碳酸根离子)构成的含氧酸盐,也属于碳酸盐,
故答案为:CE;
(2)烈火焚烧若等闲:碳酸钙高温分解生成氧化钙和二氧化碳,反应的化学方程式为:CaCO3$\frac{\underline{\;高温\;}}{\;}$CaO+CO2↑,该反应属于分解反应,二氧化碳为温室效应气体,所以BC符合,
故答案为:BC;
(3)“粉身碎骨浑不怕”:氧化钙与水反应生成氢氧化钙,反应的化学方程式为:CaO+H2O═Ca(OH)2,该反应属于化合反应,“烈火焚烧若等闲”碳酸钙高温分解生成氧化钙和二氧化碳,反应的化学方程式为:CaCO3$\frac{\underline{\;高温\;}}{\;}$CaO+CO2↑,该反应属于分解反应,
故答案为:CaO+H2O═Ca(OH)2;CaCO3$\frac{\underline{\;高温\;}}{\;}$CaO+CO2↑;
(4)要留清白在人间:氢氧化钙与空气中的二氧化碳反应生成碳酸钙沉淀和水,反应的化学方程式为:Ca(OH)2+CO2═CaCO3↓+H2O.诗中涉及的反应,CaCO3$\frac{\underline{\;高温\;}}{\;}$CaO+CO2↑;CaO+H2O═Ca(OH)2;Ca(OH)2+CO2═CaCO3↓+H2O,未涉及氧化还原反应,
故答案为:否;
(5)诗中涉及的物质及其摩尔质量分别为CaCO3(100g/mol)、CaO(56g/mol)、CO2(44g/mol)、H2O(18g/mol)、Ca(OH)2(74g/mol)、摩尔质量最大的是CaCO3,50g该物质中原子的总数N=$\frac{50g}{100g/mol}$×5NA=2.5NA,
故答案为:CaCO3;100 g/mol;2.5NA.
点评 本题难度不大,明确诗句的含义、碳酸钙与氧化钙、氢氧化钙之间的转化、化学方程式的书写是正确解答本题的关键,注意物质的量公式的熟练应用.


科目:高中化学 来源: 题型:解答题
| 溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN |
| pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 化学学科中的平衡理论主要包括:化学平衡、电离平衡、水解平衡和溶解平衡四种,且均符合勒夏特列原理.请回答下列问题:
化学学科中的平衡理论主要包括:化学平衡、电离平衡、水解平衡和溶解平衡四种,且均符合勒夏特列原理.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
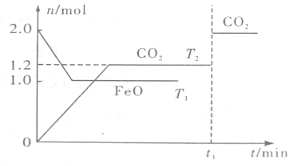
| A. | 平衡前,随着反应的进行,容器内气体的相对分子质量始终不变 | |
| B. | 平衡时,其他条件不变,取出适当铁可提高CO的转化率 | |
| C. | 该反应的△H<0,T1>T2 | |
| D. | 当反应进行到t1时刻仅改变一个条件,可能是通入了氮气 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
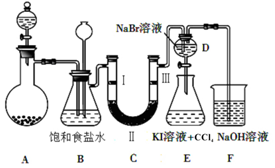
| a | b | c | d | |
| Ⅰ | 干燥的有色布条 | 干燥的有色布条 | 湿润的有色布条 | 湿润的有色布条 |
| Ⅱ | 碱石灰 | 硅胶 | 浓硫酸 | 无水氯化钙 |
| Ⅲ | 湿润的有色布条 | 湿润的有色布条 | 干燥的有色布条 | 干燥的有色布条 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| X | Y | ||
| W | Z |
| A. | X只能形成一种氢化物 | |
| B. | W、X、Y的原子半径依次增大 | |
| C. | X的简单氢化物的热稳定性比Y的小 | |
| D. | W的最高价氧化物对应的水化物能溶于稀氨水 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 通入HBr | B. | 加入NaCO3溶液 | C. | 加入NaBr | D. | 加入Na2SO3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氧化剂是SiO2 | |
| B. | 氧化剂与还原剂的物质的量之比为1:2 | |
| C. | 由反应可得C的还原性比Si强 | |
| D. | 若生成1 mol SiC,则转移电子2 mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com