
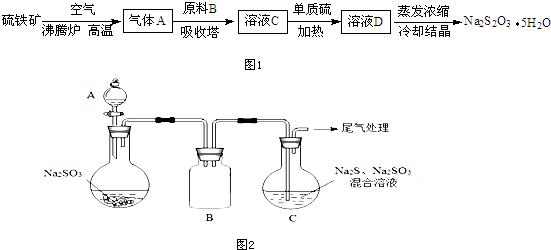
·ÖĪö ĮņĢśæóŌŚ·ŠĢŚĀÆÖŠČ¼ÉÕÉś³ÉŃõ»ÆĢśÓė¶žŃõ»ÆĮņ£¬ĘųĢåAĪŖ¶žŃõ»ÆĮņ£¬ČÜŅŗDÕō·¢ÅØĖõ”¢ĄäČ“½į¾§µĆµ½Įņ“śĮņĖįÄĘ¾§Ģ壬¹ŹDĪŖNa2S2O3£¬µ„ÖŹµ„ÖŹĮņÓėŃĒĮņĖįŃĪæÉŅŌ¹²ČČÉś³ÉĮņ“śĮņĖįŃĪ£¬ŌņČÜŅŗCĪŖNa2SO3£¬¹ŹŌĮĻBĪŖæÉŅŌĪŖĢ¼ĖįÄĘČÜŅŗ»ņĒāŃõ»ÆÄĘČÜŅŗ£®
£Ø1£©Ź¹¹ĢĢåÓėĘųĢå³ä·Ö½Ó“„£¬¼Óæģ·“Ó¦ĖŁĀŹ£»
£Ø2£©BĻ”ŹĶ¶žŃõ»ÆĮņ×Ŗ»ÆĪŖŃĒĮņĖįÄĘ£»
£Ø3£©AĪŖÖʱø¶žŃõ»ÆĮņ£¬¶žŃõ»ÆĮņŌŚCÖŠÓėĮņ»ÆÄĘČÜŅŗ·“Ó¦µĆµ½Įņ»ÆĒā£¬Įņ»ÆĒāÓė¶žŃõ»ÆĮņ·“Ó¦µĆµ½Sµ„ÖŹ£¬Sµ„ÖŹÓėŃĒĮņĖįÄĘ·“Ó¦µĆµ½Įņ“śĮņĖįÄĘ£¬CÖŠ·“Ó¦µ¼ÖĀ×°ÖĆÄŚŃ¹Ēæ¼õŠ”£¬B×°ÖĆ×÷ÓĆŹĒ·ĄÖ¹µ¹Īü£»
£Ø4£©ÓÉĢāÄæŠÅĻ¢æÉÖŖ£¬FeS2ÓėHCl·“Ӧɜ³ÉH2S”¢S£¬Ķ¬Ź±»¹Éś³ÉFeCl2£®
½ā“š ½ā£ŗĮņĢśæóŌŚ·ŠĢŚĀÆÖŠČ¼ÉÕÉś³ÉŃõ»ÆĢśÓė¶žŃõ»ÆĮņ£¬ĘųĢåAĪŖ¶žŃõ»ÆĮņ£¬ČÜŅŗDÕō·¢ÅØĖõ”¢ĄäČ“½į¾§µĆµ½Įņ“śĮņĖįÄĘ¾§Ģ壬¹ŹDĪŖNa2S2O3£¬µ„ÖŹµ„ÖŹĮņÓėŃĒĮņĖįŃĪæÉŅŌ¹²ČČÉś³ÉĮņ“śĮņĖįŃĪ£¬ŌņČÜŅŗCĪŖNa2SO3£¬¹ŹŌĮĻBĪŖæÉŅŌĪŖĢ¼ĖįÄĘČÜŅŗ»ņĒāŃõ»ÆÄĘČÜŅŗ£®
£Ø1£©·ŠĢŚĀÆÖŠ½«·ŪĖéµÄĮņĢśæóÓĆæÕĘų“µ¶ÆŹ¹Ö®“ļµ½”°·ŠĢŚ”±×“Ģ¬£¬ĘäÄæµÄŹĒ£ŗŹ¹¹ĢĢåÓėĘųĢå³ä·Ö½Ó“„£¬¼Óæģ·“Ó¦ĖŁĀŹ£¬
¹Ź“š°øĪŖ£ŗŹ¹¹ĢĢåÓėĘųĢå³ä·Ö½Ó“„£¬¼Óæģ·“Ó¦ĖŁĀŹ£»
£Ø2£©BĪüŹÕ¶žŃõ»ÆĮņ×Ŗ»ÆĪŖŃĒĮņĖįÄĘ£¬Ģ¼ĖįÄĘæÉŅŌÓė¶žŃõ»ÆĮņ·“Ӧɜ³ÉŃĒĮņĖįÄĘÓė¶žŃõ»ÆĢ¼£¬¶ųNaCl”¢ĮņĖįÄĘ²»Óė¶žŃõ»ÆĮņ·“Ó¦£¬¹ŹŃ”£ŗB£»
£Ø3£©AĪŖÖʱø¶žŃõ»ÆĮņ£¬¶žŃõ»ÆĮņŌŚCÖŠÓėĮņ»ÆÄĘČÜŅŗ·“Ó¦µĆµ½Įņ»ÆĒā£¬Įņ»ÆĒāÓė¶žŃõ»ÆĮņ·“Ó¦µĆµ½Sµ„ÖŹ£¬Sµ„ÖŹÓėŃĒĮņĖįÄĘ·“Ó¦µĆµ½Įņ“śĮņĖįÄĘ£¬CÖŠ·“Ó¦µ¼ÖĀ×°ÖĆÄŚŃ¹Ēæ¼õŠ”£¬B×°ÖĆ×÷ÓĆŹĒ·ĄÖ¹µ¹Īü£®
¢ŁøĆ·“Ó¦µÄŹµÖŹŹĒH+ÓėSO32-·“Ó¦£¬70%µÄĮņĖįÖŠŗ¬Ė®½Ļ¶ą£¬c£ØH+£©ŗĶc£ØSO32-£©¶¼½Ļ“ó£¬Éś³ÉSO2ĖŁĀŹøüæģ£»B×°ÖƵÄ×÷ÓĆŹĒ·ĄÖ¹µ¹Īü£¬
¹Ź“š°øĪŖ£ŗøĆ·“Ó¦µÄŹµÖŹŹĒH+ÓėSO32-·“Ó¦£¬70%µÄĮņĖįÖŠŗ¬Ė®½Ļ¶ą£¬c£ØH+£©ŗĶc£ØSO32-£©¶¼½Ļ“ó£¬Éś³ÉSO2ĖŁĀŹøüæģ£»·ĄÖ¹µ¹Īü£»
¢ŚCÖŠÖʱøNa2S2O3·¢ÉśµÄĮ¬Šų·“Ó¦ÓŠ£ŗNa2S+H2O+SO2ØTNa2SO3+H2S”¢2H2S+SO2ØT3S”ż+2H2O »ņ 2H2S+H2SO3ØT3S”ż+3H2O ŗĶNa2SO3+S $\frac{\underline{\;\;”÷\;\;}}{\;}$Na2S2O3£¬
¹Ź“š°øĪŖ£ŗ2H2S+SO2ØT3S”ż+2H2O »ņ 2H2S+H2SO3ØT3S”ż+3H2O ŗĶNa2SO3+S $\frac{\underline{\;\;”÷\;\;}}{\;}$Na2S2O3£»
£Ø4£©ÓÉĢāÄæŠÅĻ¢æÉÖŖ£¬FeS2ÓėHCl·“Ӧɜ³ÉH2S”¢S£¬Ķ¬Ź±»¹Éś³ÉFeCl2£¬·“Ó¦·½³ĢŹ½ĪŖ£ŗFeS2+2HClØTFeCl2+H2S”ü+S£¬
¹Ź“š°øĪŖ£ŗFeS2+2HClØTFeCl2+H2S”ü+S£®
µćĘĄ ±¾Ģāæ¼²éÖʱø·½°øÉč¼Ę£¬²ąÖŲæ¼²éѧɜ¶Ō²Ł×÷²½Öč”¢ŌĄķµÄ·ÖĪöĘĄ¼Ū£¬ŹĒ¶Ōѧɜ×ŪŗĻÄÜĮ¦µÄ漲飬ÄѶČÖŠµČ£®


 ŌĶĮæģ³µĻµĮŠ“š°ø
ŌĶĮæģ³µĻµĮŠ“š°ø
| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A | ÓĆĶ¼¢Ł×°ÖĆÕō·¢Ļ”ŃĪĖįÖĘÅØŃĪĖį |
| B | ÓĆĶ¼¢Ś×°ÖĆ·ÖŅŗŹ±£¬ĻĀ²ćŅŗĢå“Ó·ÖŅŗĀ©¶·ĻĀæŚ·Å³ö£¬¹Ų±Õ»īČūŌŁ½«ÉĻ²ćŅŗĢå“ÓÉĻæŚµ¹³ö |
| C | ÓĆĶ¼¢ŪĻ“µÓ³ĮµķŹ±£¬Ā©¶·ÖŠ¼ÓČėŹŹĮæÕōĮóĖ®£¬½Į°č²¢ĀĖøÉ |
| D | ÓĆĶ¼¢Ü×°ÖĆ£¬·ÖĄėĖÄĀČ»ÆĢ¼Óė±½µÄ»ģŗĻČÜŅŗ |

| A£® | A | B£® | B | C£® | C | D£® | D |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | Ķõ°²ŹÆµÄ”¶ŌŖČÕ”·£ŗ”°±¬ÖńÉłÖŠŅ»Ėź³ż£¬“ŗ·ēĖĶÅÆČėĶĄĖÕ”± | |
| B£® | ĮõÓķĪżµÄ”¶ĄĖĢŌɳ”·£ŗ”°ĆĄČĖŹ×ŹĪŗīĶõÓ”£¬¾”ŹĒ½ÖŠĄĖµ×Ą“”± | |
| C£® | ĮõēūµÄ”¶ÖŲŌłĀ¬ŚČ”·£ŗ”°ŗĪŅā°ŁĮ¶øÖ£¬»ÆĪŖČĘÖøČį”± | |
| D£® | ĄīÉĢŅžµÄ”¶ĪŽĢā”·£ŗ”°“ŗ²Ļµ½ĖĄĖæ·½¾”£¬ĄÆ¾ę³É»ŅĄįŹ¼øÉ”± |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ÉżøßĪĀ¶Č£¬¹ĢĢåµÄĮæ¼õÉŁ | |
| B£® | ¼ÓČėÉŁĮæNa2CO3·ŪÄ©ÄÜŌö“óøĘĄė×ÓµÄÅØ¶Č | |
| C£® | ŗćĪĀĻĀ¼ÓČėÉŁĮæCaO£¬ČÜŅŗµÄpHŌö“ó | |
| D£® | ½µµĶĪĀ¶Č£¬ČÜŅŗÖŠc£ØOH-£©Ōö“ó |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ¶ąŃ”Ģā
 ½«N2£¬H2°“ĪļÖŹµÄĮæ±ČĪŖ1£ŗ3µÄ±ČĄż»ģŗĻÓŚ5LµÄŗćČŻĆܱÕČŻĘ÷ÖŠ½ųŠŠ·“Ó¦N2+3H2?2NH3£¬”÷H£¼0£¬ČōøĆ·“Ó¦µÄÄę·“Ó¦ĖŁĀŹĖꏱ¼ä±ä»ÆµÄ¹ŲĻµČēĶ¼ĖłŹ¾£®Ōņt1Ź±øıäµÄĢõ¼ž²»æÉÄÜŹĒ£Ø””””£©
½«N2£¬H2°“ĪļÖŹµÄĮæ±ČĪŖ1£ŗ3µÄ±ČĄż»ģŗĻÓŚ5LµÄŗćČŻĆܱÕČŻĘ÷ÖŠ½ųŠŠ·“Ó¦N2+3H2?2NH3£¬”÷H£¼0£¬ČōøĆ·“Ó¦µÄÄę·“Ó¦ĖŁĀŹĖꏱ¼ä±ä»ÆµÄ¹ŲĻµČēĶ¼ĖłŹ¾£®Ōņt1Ź±øıäµÄĢõ¼ž²»æÉÄÜŹĒ£Ø””””£©| A£® | ÉżĪĀ | B£® | Ź¹ÓĆ“ß»Æ¼Į | C£® | ¼ÓČėŅ»¶ØĮæNH3 | D£® | ¼ÓČėŅ»¶ØĮæN2 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā

²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ¼“Ź¹Ć»ÓŠĪļÖŹµÄ±ä»Æ£¬Ņ²æÉÄÜÓŠÄÜĮæµÄ±ä»Æ | |
| B£® | Ļ”ĮņĖįŗĶĒāŃõ»Æ±µČÜŅŗ·“Ӧɜ³É1molĖ®ŹĶ·ÅµÄČČĮ漓ĪŖÖŠŗĶČČ | |
| C£® | S£Øg£©+O2£Øg£©ØTSO2£Øg£©”÷H=a£»S£Øs£©+O2£Øg£©ØTSO2£Øg£©”÷H=b£»Ōņa£¾b | |
| D£® | Č¼ÉÕČČĖę»Æѧ·½³ĢŹ½Ē°µÄ»Æѧ¼ĘĮæŹżµÄøıä¶ųøıä |
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com