
 肉桂酸在有机合成化工方面有着极其重要的作用.其结构简式如图所示:
肉桂酸在有机合成化工方面有着极其重要的作用.其结构简式如图所示: ,故答案为:
,故答案为: ;
;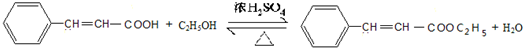 ,
,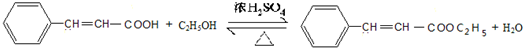 ;
;

 字词句段篇系列答案
字词句段篇系列答案科目:高中化学 来源: 题型:
| A、0.56 L 甲烷中含有的共价键数为0.1NA |
| B、标准状况下,8g SO3含有的氧原子数为0.3NA |
| C、反应KClO3+6HCl═KCl+3Cl2↑+H2O中,每1 mol KClO3参与反应,转移e-数为6NA |
| D、pH=1的稀硫酸中含有的H+数为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、医药中常用酒精消毒是因为酒精能够使细菌蛋白体发生盐析 |
| B、开发清洁能源汽车(如太阳能汽车等)能减少或控制汽车尾气污染 |
| C、目前废旧电池的回收,主要是为了防止电池中NH4Cl对水资源的污染 |
| D、为了防止中秋月饼等富脂食品氧化变质,可在包装袋中放入生石灰 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
 ,它可以发生如下反应:
,它可以发生如下反应:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、CH3COONa溶液中:c(Na+)=c(CH3COO-) |
| B、pH=3的醋酸溶液加水稀释过程中:溶液中各离子浓度均变小 |
| C、pH相同的NaOH溶液与NaHCO3溶液中:水的电离程度相同 |
| D、pH=9的NaHX溶液中:c(H2X)>c(X2-) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com