
| A. | 标准状况下22.4LH20中共价键总数为2NA | |
| B. | 32gO3中含有NA个氧原子 | |
| C. | 向装有催化剂的密闭容器加入1molN2和3 mol H2,充分反应后得2NA个NH3分子 | |
| D. | 1.8g的NH4+中含有电子的物质的量为1mol |
分析 A、水在标准状况下不是气体;
B、32gO3中含有NA个氧原子为:$\frac{32g}{48g/mol}×3$=2mol=2NA;
C、因可逆反应,1molN2和3 mol H2,充分反应后得不到2NA个NH3分子;
D、1.8g的NH4+中含有电子的物质的量为$\frac{1.8g}{18g/mol}×10$=1mol.
解答 解:A、水在标准状况下不是气体,22.4L水物质的量不是1mol,故A错误;
B、32gO3中含有NA个氧原子为:$\frac{32g}{48g/mol}×3$=2mol=2NA,故B错误;
C、因可逆反应,1molN2和3 mol H2,充分反应后得不到2NA个NH3分子,故C错误;
D、1.8g的NH4+中含有电子的物质的量为$\frac{1.8g}{18g/mol}×10$=1mol,故D正确;
故选D.
点评 本题考查了阿伏伽德罗常数的应用,主要是取代基的电子数计算,气体摩尔体积的条件应用,氧化还原反应的电子数计算,碳化钙的构成离子的判断.


科目:高中化学 来源: 题型:解答题
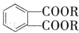 (代号DMP)是一种常用的酯类塑化剂,其相对分子质量为194.工业上生产DMP的流程如图所示:
(代号DMP)是一种常用的酯类塑化剂,其相对分子质量为194.工业上生产DMP的流程如图所示: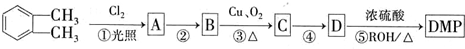
 .
.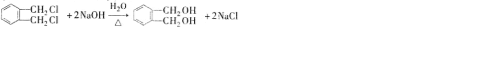 .
. .
. 制备DMP的另一种途径:
制备DMP的另一种途径: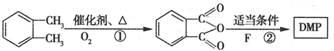
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ;NH3在同族元素形成的氢化物中具有较高的沸点,其原因是NH3分子间有氢键.
;NH3在同族元素形成的氢化物中具有较高的沸点,其原因是NH3分子间有氢键.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
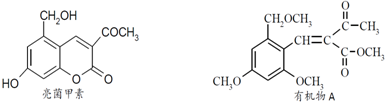


 .
. .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na20和SiO2熔化 | B. | 冰和金刚石熔化 | ||
| C. | 氯化钠和蔗糖熔化 | D. | 碘和干冰升华 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
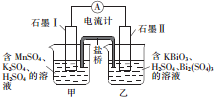 已知KBiO2+MnSO4+H2SO4→Bi2(SO4)3+KMnO4+H2O+K2SO4(未配平),利用上述化学反应设计成如图所示原电池(盐桥中装有含琼胶的饱和K2SO4溶液),下列说法正确的是( )
已知KBiO2+MnSO4+H2SO4→Bi2(SO4)3+KMnO4+H2O+K2SO4(未配平),利用上述化学反应设计成如图所示原电池(盐桥中装有含琼胶的饱和K2SO4溶液),下列说法正确的是( )| A. | 电池工作时,电子移向为石墨Ⅰ→溶液→盐桥→溶液→石墨Ⅱ | |
| B. | 电池工作时,盐桥中的K+移向甲烧杯 | |
| C. | 甲烧杯中发生的电极反应为Mn2+-4e-+4H2O═MnO4-+8H+ | |
| D. | 电池工作一段时间后乙烧杯中溶液的pH增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 用氨水鉴别Al3+、Mg2+和Ag+ | |
| B. | 用盐酸、BaCl2溶液鉴别Cl-、SO42-和CO32- | |
| C. | 用溴水鉴别CH4和C2H4 | |
| D. | 用KMnO4酸性溶液鉴别CH3CH2OH和CH3CHO |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
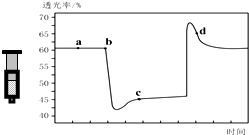 已知反应:2NO2 (红棕色)?N2O4(无色)△H<0.将一定量的NO2充入注射器中后封口,如图是在拉伸和压缩注射器的过程中气体透光率随时间的变化(气体颜色越深,透光率越小).下列说法正确的是( )
已知反应:2NO2 (红棕色)?N2O4(无色)△H<0.将一定量的NO2充入注射器中后封口,如图是在拉伸和压缩注射器的过程中气体透光率随时间的变化(气体颜色越深,透光率越小).下列说法正确的是( )| A. | b点的操作是压缩注射器 | |
| B. | c点与a点相比,c(NO2)增大,c(N2O4)减小 | |
| C. | d 点:v(正)>v(逆) | |
| D. | 若不忽略体系温度变化,且没有能量损失,则T(b)>T(c) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com