
 .
. 分析 (1)先判断晶体的类型,一般来说晶体的熔点原子晶体>离子晶体>金属晶体>分子晶体,据此分析;
(2)分子晶体的构成微粒为分子,但稀有气体形成的分子晶体由原子构成的分子;根据VSEPR模型判断分子构型;根据中心原子价层电子对数判断杂化类型;
(3)离子晶体的构成微粒为阴阳离子;
(4)阴阳离子间以静电作用形成的化合物为离子化合物,不同种非金属之间形成极性共价键.
解答 解:(1)干冰、四氢化碳常温下为气体,其晶体为分子晶体;氯过氧化钠、氯化铵为离子晶体;金刚石、二氧化硅晶体、晶体硅为原子晶体,金刚石是由C-C键形成,二氧化硅由Si-O键形成,硅单质由Si-Si键形成,其中C-C键键长最短,键能最大,所以熔点最高的是金刚石,故答案为:②;
(2)干冰、四氢化碳都是由分子构成的分子晶体,其中干冰为直线型分子,四氢化碳中心原子C电子对数为$\frac{4+1×4}{2}$=4,杂化方式为sp3,孤电子对数为0,分子构型为正四面体,故答案为:①③;③;sp3;
(3)过氧化钠、氯化铵都是由离子构成的离子晶体,故答案为:⑤⑦;
(4)NH4Cl中阴阳离子之间形成离子键,铵根离子中含有极性键和配位键;所以既含有离子键,又含有极性键和配位键的离子晶体是NH4Cl,其电子式为 ,故答案为:
,故答案为: .
.
点评 本题考查晶体类型与结构、化学键、电子式知识点,侧重于学生的化学用语的考查,注意相关知识的学习,把握书写方法,难度不大.


 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案科目:高中化学 来源: 题型:选择题
| A. | Na2O2、CaCl2 | B. | CO2、CH4 | C. | NH4Cl、NaOH | D. | NaF、HNO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验目的 | 实验方案 |
| A | 检验Fe2O3中是否含有FeO | 向少量固体样品中加入适量稀硝酸溶解后,再滴加少量的高锰酸钾溶解 |
| B | 测定NaHCO3和NH4Cl固体混合物中NaHCO3 的质量分数 | 准确称取ag样品和坩埚总质量,加强热后在空 气中冷却至室温,再称量得到总质量为bg |
| C | 探究温度对化学平衡的影响 | 把装有颜色相同的NO2和N2O4混合气体的两支试管(密封)分别浸入冷水和热水中 |
| D | 除去CO2气体中混有的少量HCl气体 | 将混合气体依次通过盛有饱和Na2CO3溶液和浓H2SO4的洗气瓶 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲烷的4个碳氢键的键能相等 | B. | 甲烷的4个碳氢键的键长相等 | ||
| C. | 甲烷的一氯代物只有1种 | D. | 甲烷的二氯代物只有1种 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
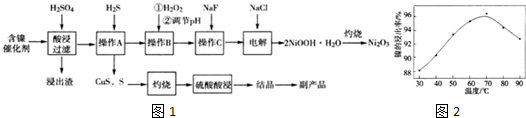
| 氢氧化物 | Fe(OH)3 | Fe(OH)2 | Ni(OH02 |
| 开始沉淀的pH | 1.5 | 6.5 | 7.7 |
| 沉淀完全的pH | 3.7 | 9.7 | 9.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯气以液态形式存在时可称为氯水或液氯 | |
| B. | 红热的铜丝在氯气中燃烧,冒蓝色烟 | |
| C. | 有氯气参加的化学反应必须在溶液中进行 | |
| D. | 钠在氯气中燃烧生成白色固体氯化钠 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 呈碱性 | B. | 呈酸性 | C. | 呈中性 | D. | 无法判断 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 被氧化为
被氧化为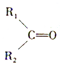 和
和 (R1、R2、R3、R4表示烃基或氢原子).由此推断分子式为C5H10的烯烃所有可能的氧化产物有( )
(R1、R2、R3、R4表示烃基或氢原子).由此推断分子式为C5H10的烯烃所有可能的氧化产物有( )| A. | 5种 | B. | 6种 | C. | 7种 | D. | 8种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 蔗糖在硫酸催化下水解,只生成葡萄糖 | |
| B. | 石油的裂解、煤的干馏都是化学变化 | |
| C. | 1L1mol•L-1AlCl3溶液中含Al3+数目为6.02×1023 | |
| D. | 等质量的铝粉按a、b两种途径完全转化,途径a比途径b消耗更多的NaOH 途径a:Al$→_{点燃}^{O_{2}}$Al2O3$\stackrel{NaOH溶液}{→}$NaAlO2;途径b:Al$\stackrel{NaOH溶液}{→}$NaAlO2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com