
| A. |  根据图可判断正反应的△H<0 | |
| B. |  根据图,除去CuSO4溶液中的Fe3+,可加入CuO调节pH至3~5 | |
| C. | 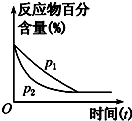 图可表示压强(p)对反应2A(g)+2B(g)?3C(g)+D(s)的影响 | |
| D. |  图为水的电离平衡曲线图,若从A点到C点,可采用在水中加入适量NaOH固体的方法 |
分析 A、图象分析可知开始逆反应速率大于正反应速率,达到平衡后,继续升温正反应速率大于逆反应速率,平衡正向进行;
B、加入氧化铜和水解生成的酸反应,促进铁离子水解正向进行,到PH=3-5铁离子沉淀完全,铜离子未沉淀;
C、先拐先平压强大,压强越大平衡正向进行,反应物百分含量减小;
D、水溶液中的离子积随温度变化,不随浓度变化,C点氢离子浓度和氢氧根离子浓度相同,依据数据说明是温度的升高发生的变化.
解答 解:A、图象分析可知开始逆反应速率大于正反应速率,达到平衡后,继续升温正反应速率大于逆反应速率,平衡正向进行,正反应的△H>0,故A错误;
B、加入氧化铜和水解生成的酸反应,促进铁离子水解正向进行,到PH=3-5铁离子沉淀完全,铜离子未沉淀,可以除去CuSO4溶液中的Fe3+,故B正确;
C、先拐先平压强大,反应是气体体积减小的反应,压强越大平衡正向进行,反应物百分含量减小,图象不符合,故C错误;
D、水溶液中的离子积随温度变化,不随浓度变化,C点氢离子浓度和氢氧根离子浓度相同,依据数据说明是温度的升高发生的变化,在水中加入适量NaOH固体的溶解后离子积常数不变,故D错误;
故选B.
点评 本题考查了反应速率影响因素分析,酸碱反应浓度变化图象分析判断,盐类水解平衡的影响因素分析,水溶液中离子积常数随温度变化,题目难度中等.


科目:高中化学 来源: 题型:填空题
 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
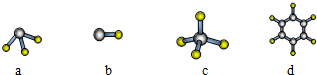
| A. | 海水提溴的过程中不发生氧化还原反应 | |
| B. | 铁的冶炼过程是利用置换反应得到单质铁 | |
| C. | 石油分馏是物理变化,可得到汽油、煤油和柴油等 | |
| D. | CO2、NO2或者SO2都会导致酸雨的形成 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
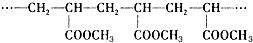
| A. | 它是缩聚反应的产物 | B. | 高分子的分子式是C4H6O2 | ||
| C. | 合成它的单体是CH2=CHCOOCH3 | D. | 高分子的相对分子质量是86 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
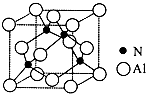 Ⅰ. 已知氮化铝的晶胞结构如图所示,请回答下列问题.
Ⅰ. 已知氮化铝的晶胞结构如图所示,请回答下列问题.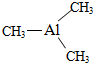 ,则其
,则其查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 化学计量数的关系:b<c | |
| B. | 容器的容积减小后,该反应的逆反应速率减小 | |
| C. | 原容器中用B浓度变化表示该反应在1 min内的速率为$\frac{cx}{b}$mol•(L•min)-1 | |
| D. | 若保持温度和容器容积不变,充入氦气(不参与反应),平衡不发生移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用自来水烧开水热水壶底常沉积一层水垢,说明蒸馏水不是纯净物 | |
| B. | 用自来水配制的硝酸银溶液出现浑浊现象,说明自来水中含有氯化银杂质 | |
| C. | 用蒸馏的方法可以从海水中提取淡水,说明水和食盐的沸点不同 | |
| D. | 少量水洒到烧旺的煤炉中火焰会更猛烈,说明一定条件下水能燃烧 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com