
| A. | v(NO)=0.0010mol•L-1•s-1 | B. | v(O2)=0.0010mol•L-1•s-1 | ||
| C. | v(NH3)=0.0100mol•L-1•s-1 | D. | v(H2O)=0.045mol•L-1•s-1 |
分析 在10L密闭容器中进行,半分钟后,水蒸气的物质的量加了0.45mol,则v(H2O)=$\frac{\frac{0.45mol}{10L}}{30s}$=0.015mol•L-1•s-1,结合反应速率之比等于化学计量数之比计算,以此来解答.
解答 解:在10L密闭容器中进行,半分钟后,水蒸气的物质的量加了0.45mol,则v(H2O)=$\frac{\frac{0.45mol}{10L}}{30s}$=0.0015mol•L-1•s-1,
由反应速率之比等于化学计量数之比可知,
v(NH3)=v(NO)=0.0015mol•L-1•s-1×$\frac{4}{6}$=0.0010mol•L-1•s-1,
v(O2)=0.0015mol•L-1•s-1×$\frac{5}{6}$=0.00125mol•L-1•s-1,
故选A.
点评 本题考查化学反应速率,为高频考点,把握反应速率的计算公式及反应速率与化学计量数的关系为解答的关键,侧重分析与计算能力的考查,题目难度不大.


 期末好成绩系列答案
期末好成绩系列答案 99加1领先期末特训卷系列答案
99加1领先期末特训卷系列答案 百强名校期末冲刺100分系列答案
百强名校期末冲刺100分系列答案 好成绩1加1期末冲刺100分系列答案
好成绩1加1期末冲刺100分系列答案 金状元绩优好卷系列答案
金状元绩优好卷系列答案科目:高中化学 来源: 题型:选择题

| A. | 异丙苯的分子式为C9H12 | |
| B. | 异丙苯能使酸性高锰酸钾溶液褪色 | |
| C. | 异丙苯中碳原子可能都处于同一平面 | |
| D. | 异丙苯的和苯为同系物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
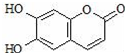
| A. | 与稀H2SO4混合加热不反应 | |
| B. | 不能使酸性高锰酸钾溶液褪色 | |
| C. | 1mol 瑞香素最多能与3mol Br2发生反应 | |
| D. | 1mol瑞香素与足量的NaOH溶液发生反应时,消耗NaOH 2mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溶液中可以同时含有Fe2+、NO3- | B. | 溶液中一定有OH-、Na+ | ||
| C. | 溶液中可能含有Na+、H+、Mg2+、NO3- | D. | 若X是AlO2-,则上述离子最多有2种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH≡CH→CH2═CHCN | B. | C2H5Cl→CH2═CH2 | ||
| C. | C6H6→C6H6-NO2 | D. | CH3COOH→CH3COOC2H5 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 X、Y、Z是三种短周期元素,X和Z的质子数之和与Y的质子数相等,Z的电子层数是X的电子层数的2倍.A、B、C、D、E、F是中学化学中的常见物质,它们由上述三种元素中的一种、两种或三种组成,其中A是能使湿润红色石蕊试纸变蓝的气体,D、E是两种酸,F是一种单质,反应③④均在微生物作用下进行,其转化关系如图所示:
X、Y、Z是三种短周期元素,X和Z的质子数之和与Y的质子数相等,Z的电子层数是X的电子层数的2倍.A、B、C、D、E、F是中学化学中的常见物质,它们由上述三种元素中的一种、两种或三种组成,其中A是能使湿润红色石蕊试纸变蓝的气体,D、E是两种酸,F是一种单质,反应③④均在微生物作用下进行,其转化关系如图所示: .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Mg2+ | B. | Mg2+、Fe2+ | C. | Fe2+ | D. | Mg2+、Al3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
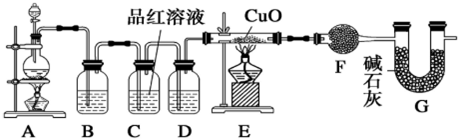
查看答案和解析>>
科目:高中化学 来源:2016-2017学年陕西省高二上月考一化学卷(解析版)) 题型:选择题
高温下,某反应达平衡,平衡常数K=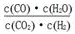 。恒容时,温度升高,H2浓度减小,下列说法正确的是
。恒容时,温度升高,H2浓度减小,下列说法正确的是
A.该反应的焓变为正值
B.恒温恒容下,增大压强,H2浓度一定减小
C.升高温度,逆反应速率减小
D.该反应化学方程式为CO+H2O CO2+H2
CO2+H2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com