
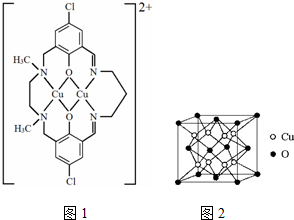
分析 (1)Cu原子核外电子数为29,根据能量最低原理与洪特规则特例书写;
(2)Cu2Zn合金的晶体类型是金属晶体;
(3)①由图可知,铜离子与N、O原子之间形成配位键,非金属原子之间形成共价键;
②离子中第二周期元素为C、N、O,同周期自左而右第一电离能呈增大趋势,但N元素原子2p能级容纳3个电子,为半满稳定状态,第一电离能高于同周期相邻元素;
③离子中存在C=N双键中的N原子形成3个σ键,另外N原子形成4个σ键,均没有孤电子对;
(4)Cu原子处于晶胞内部,O原子处于晶胞顶点与面心,利用均摊法计算晶胞中Cu原子、O原子数目,进而确定晶体的化学式;以上底面面心O原子研究,与之最近的Cu原子有8个,为晶胞中上层4个Cu原子,及面心氧原子所在另外晶胞中下层4个Cu原子,根据ρ=$\frac{m}{V}$计算.
解答 解:(1)Cu原子核外电子数为29,根据能量最低原理与洪特规则特例,其核外电子排布为:1s22s22p63s23p63d104s1,故答案为:1s22s22p63s23p63d104s1;
(2)Cu2Zn合金的晶体类型是金属晶体,故答案为:金属晶体;
(3)①由图可知,铜离子与N、O原子之间形成配位键,非金属原子之间形成共价键,故选:bc;
②离子中第二周期元素为C、N、O,同周期自左而右第一电离能呈增大趋势,但N元素原子2p能级容纳3个电子,为半满稳定状态,第一电离能高于同周期相邻元素,故第一电离能:N>O>C,故答案为:N>O>C;
③离子中存在C=N双键中的N原子形成3个σ键,另外N原子形成4个σ键,均没有孤电子对,分别采取sp2、sp3杂化,故答案为:sp2、sp3杂化;
(4)Cu原子处于晶胞内部,O原子处于晶胞顶点与面心,晶胞中Cu原子数目为8、O原子数目为8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,故晶体的化学式为Cu2O;以上底面面心O原子研究,与之最近的Cu原子为晶胞中上层4个Cu原子,及面心氧原子所在另外晶胞中下层4个Cu原子,O原子配位数为8,晶胞中Cu原子数目为8、O原子数目为4,晶胞体积V=(d×10-7cm)3,则ρ=$\frac{m}{V}$=$\frac{\frac{(8×64+4×16)}{{N}_{A}}}{(d×1{0}^{-7})^{3}}$=$\frac{576×1{0}^{21}}{{d}^{3}{N}_{A}}$,故答案为:Cu2O;8;$\frac{576×1{0}^{21}}{{d}^{3}{N}_{A}}$.
点评 本题是对物质结构的考查,涉及核外电子排布、晶体类型与性质、电离能、化学键、杂化方式、晶胞计算等,需要学生具备扎实的基础,难度中等.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 纯净物 | 混合物 | 强电解质 | 弱电解质 | 非电解质 | |
| A | 盐酸 | 水煤气 | 硫酸 | 次氯酸 | 干冰 |
| B | 冰 | 氨水 | 碳酸钙 | 氢氟酸 | 氨气 |
| C | 氯水 | 漂白粉 | 苛性钾 | 氢硫酸 | 氯化银 |
| D | 胆矾 | 福尔马林 | 氯化钡 | 碳酸 | 氯气 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ${\;}_{81}^{203}$Tl和${\;}_{81}^{205}$Tl质子数相同 | |
| B. | ${\;}_{81}^{203}$Tl和${\;}_{81}^{205}$Tl互为同素异形体 | |
| C. | ${\;}_{81}^{203}$Tl和${\;}_{81}^{205}$Tl互为同位素 | |
| D. | ${\;}_{81}^{203}$Tl和${\;}_{81}^{205}$Tl是两种核素 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 使石蕊试液变红 | |
| B. | 与铜反应放出NO气体,生成Cu(NO3)2 | |
| C. | 与Na2CO3反应放出CO2气体,生成NaNO3 | |
| D. | 与S单质混合共热时生成H2SO4和NO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向NaCl溶液中滴加醋酸 | B. | 向KNO3溶液中滴加稀H2SO4 | ||
| C. | 向稀HCl溶液中滴加稀HNO3 | D. | 向NaOH溶液中滴加Na2CO3溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com