
 下列框图中B、C、D都是相关反应中的主要产物或反应物(部分条件、试剂被省略),且化合物B分子中仅有4个碳原子、1个溴原子、1种氢原子.
下列框图中B、C、D都是相关反应中的主要产物或反应物(部分条件、试剂被省略),且化合物B分子中仅有4个碳原子、1个溴原子、1种氢原子. ;D的系统命名的名称是:2-甲基丙烯
;D的系统命名的名称是:2-甲基丙烯分析 化合物B中仅有4个碳原子、1个溴原子、1种氢原子,则B的结构简式为 ;B水解生成C,则C的结构简式为
;B水解生成C,则C的结构简式为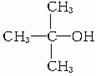 ;B、C均可发生消去反应生成D,D的结构简式为
;B、C均可发生消去反应生成D,D的结构简式为 ,D与氢气加成生成A为CH(CH3)3,A在光照条件与发生取代反应生成B,D与水发生加成生成C,D与溴化氢发生加成生成B,符合各物质的转化关系,据此解答.
,D与氢气加成生成A为CH(CH3)3,A在光照条件与发生取代反应生成B,D与水发生加成生成C,D与溴化氢发生加成生成B,符合各物质的转化关系,据此解答.
解答 解:化合物B中仅有4个碳原子、1个溴原子、1种氢原子,则B的结构简式为 ;B水解生成C,则C的结构简式为
;B水解生成C,则C的结构简式为 ;B、C均可发生消去反应生成D,D的结构简式为
;B、C均可发生消去反应生成D,D的结构简式为 ,D与氢气加成生成A为CH(CH3)3,A在光照条件与发生取代反应生成B,D与水发生加成生成C,D与溴化氢发生加成生成B,符合各物质的转化关系,
,D与氢气加成生成A为CH(CH3)3,A在光照条件与发生取代反应生成B,D与水发生加成生成C,D与溴化氢发生加成生成B,符合各物质的转化关系,
(1)根据上面的分析可知,B的结构简式为  ,D的结构简式为
,D的结构简式为 ,D的系统命名的名称是:2-甲基丙烯,
,D的系统命名的名称是:2-甲基丙烯,
故答案为: ;2-甲基丙烯;
;2-甲基丙烯;
(2)根据上面的分析可知,属于取代反应的有①②,属于消去反应的有③,
故答案为:①②;③;
(3)反应②的化学方程式为(CH3)3Br+NaOH$→_{△}^{水}$(CH3)3OH+NaBr,反应③的化学方程式为(CH3)3Br+NaOH$→_{△}^{醇}$(CH3)2CH2=CH2↑+NaBr+H2O,
故答案为:(CH3)3Br+NaOH$→_{△}^{水}$(CH3)3OH+NaBr;(CH3)3Br+NaOH$→_{△}^{醇}$(CH3)2CH2=CH2↑+NaBr+H2O.
点评 本题考查有机物推断,属于信息给予题,主要考查考生的阅读能力、自学能力、综合分析能力,推断B的结构是关键,需要学生熟练掌握官能团的衍变,难度中等.


 天天向上口算本系列答案
天天向上口算本系列答案科目:高中化学 来源: 题型:选择题
| A. | 具有较高能量的反应物分子称为活化分子 | |
| B. | 升高温度增大了活化分子百分数 | |
| C. | 化剂能够改变化学反应途径 | |
| D. | 增大压强能提高活化分子的浓度 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 50 mL 12 mol/L盐酸与足量MnO2共热,转移的电子数为0.3NA | |
| B. | 2 L 0.5 mol•L-1亚硫酸溶液中含有的H+离子数为2NA | |
| C. | 过氧化钠与水反应时,生成0.1 mol氧气转移的电子数为0.2NA | |
| D. | 密闭容器中2 mol NO与1 mol O2充分反应,产物的分子数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO2(g)+NaOH(aq)=NaHCO3(aq)△H=-(2y-x) kJ•mol-1 | |
| B. | CO2(g)+NaOH(aq)=NaHCO3(aq)△H=-(4x-y) kJ•mol-1 | |
| C. | CO2(g)+NaOH(aq)=NaHCO3(aq)△H=-(2x-y) kJ•mol-1 | |
| D. | CO2(g)+NaOH(aq)=NaHCO3(aq)△H=-(8x-2y) kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 分子式为C14H18N2O3 | |
| B. | 水解产物中有两种氨基酸 | |
| C. | 在一定条件下既能与酸反应又能与碱反应 | |
| D. | 分子中有苯环、氨基、羧基、肽键和酯的结构 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题



查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | “恶狗酒酸”的成语中涉及了氧化反应 | |
| B. | 糖类、油脂都可以用来酿酒 | |
| C. | 葡萄糖转变成酒精的过程放出热量 | |
| D. | 工业酒精中因含有剧毒物质甲醇而不能用来勾兑饮用酒水 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com